
【题目】X、Y、Z、Q、W、R六种短周期元素原子序数依次增大。化合物甲俗称苛性钠,由X、Z、Q三种元素组成。医学中常用QR溶液配制生理盐水。化合物乙由X、R两种元素组成。请回答下列问题:

(1)Q的离子结构示意图为_________。
(2)Y元素的单质及其化合物能发生如上图所示的转化,则Y元素在元素周期表中的位置__________,在甲溶液中通入少量YZ2气体,写出该反应的离子方程式:_______________。
(3)W的单质既能与甲溶液反应,又能与乙溶液反应。
①常温下,将W的单质和甲溶液混合,发生反应的离子方程式为_________________________。
②下列表述中能证明Q的金属性强于W的是______(填序号)。
a.Q单质的熔点比W单质的低
b.W的原子序数大
c.Q的最高价氧化物的水化物的碱性比W的最高价氧化物的水化物的碱性强
d.将Q、W的单质置于水中,Q单质与水剧烈反应
【答案】 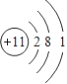 2OH-+CO2=CO32-+H2O 2Al+2OH-+2H2O═2AlO2-+3H2↑ 2Al+2OH-+2H2O═2AlO2-+3H2↑ cd
2OH-+CO2=CO32-+H2O 2Al+2OH-+2H2O═2AlO2-+3H2↑ 2Al+2OH-+2H2O═2AlO2-+3H2↑ cd
【解析】X、Y、Z、Q、W、R六种短周期元素原子序数依次增大,化合物甲俗称苛性钠,由X、Z、Q三种元素组成,X、Z、Q原子序数依次增大,所以X是H元素,Z是O元素,Q是Na元素,医学中常用QR溶液配制生理盐水,则Q为钠元素,R为氯元素,QR为氯化钠,化合物乙由H、Cl两种元素组成,所以乙是HCl;根据转化关系图可知,Y与氧气发生化合反应可生成一氧化物和二氧化物,则Y为碳元素,YZ为CO,YZ2为CO2。(1)Q是Na元素,钠原子核外有11个电子、3个电子层,钠原子结构示意为: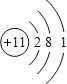 ;(2)Y为碳元素,在元素周期表中的位置为第二周期ⅣA族;在氢氧化钠溶液中通入少量二氧化碳气体,反应的离子方程式为:2OH-+CO2=CO32-+H2O;(3)W的单质既能与甲溶液反应,又能与乙溶液反应,则W为铝。①常温下,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,发生反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;②a.金属单质的熔点低金属性不一定强,故错误;b.W的原子序数大,同周期金属元素原子序数越大金属性越弱,故错误;c.Na、Al两种元素金属性的强弱为Q>W,金属的金属性越强,其对应最高价氧化物的水化物碱性越强,与酸反应越容易失去电子,故正确;d.金属的金属性越强,与水或酸反应越剧烈,故将Q、W的单质置于水中,Q单质与水剧烈反应,能说明金属性Q强,故正确。答案选cd。
;(2)Y为碳元素,在元素周期表中的位置为第二周期ⅣA族;在氢氧化钠溶液中通入少量二氧化碳气体,反应的离子方程式为:2OH-+CO2=CO32-+H2O;(3)W的单质既能与甲溶液反应,又能与乙溶液反应,则W为铝。①常温下,铝和氢氧化钠溶液反应生成偏铝酸钠和氢气,发生反应的离子方程式为:2Al+2OH-+2H2O═2AlO2-+3H2↑;②a.金属单质的熔点低金属性不一定强,故错误;b.W的原子序数大,同周期金属元素原子序数越大金属性越弱,故错误;c.Na、Al两种元素金属性的强弱为Q>W,金属的金属性越强,其对应最高价氧化物的水化物碱性越强,与酸反应越容易失去电子,故正确;d.金属的金属性越强,与水或酸反应越剧烈,故将Q、W的单质置于水中,Q单质与水剧烈反应,能说明金属性Q强,故正确。答案选cd。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】25℃时,H2O的离子积常数为1×10﹣14 mol2L﹣2 , 则该温度下:①0.01molL﹣1NaOH溶液的pH是多少?
②0.005molL﹣1H2SO4溶液中,水电离出的氢氧根浓度是多少?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的认识错误的是( )
A.裂化汽油可以提取溴水中的Br2
B.聚乙烯塑料制品可用于食品的包装
C.NaOH溶液能用于区分地沟油和矿物油
D.乙醇、乙酸和葡萄糖均可以与金属钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应IO ![]() +5I﹣+6H+3I2+3H2O设计成如图所示的原电池,甲、乙烧杯中都加入淀粉溶液.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( )
+5I﹣+6H+3I2+3H2O设计成如图所示的原电池,甲、乙烧杯中都加入淀粉溶液.开始时向甲烧杯中加入少量浓硫酸,电流计指针发生偏转,一段时间后,电流计指针回到零,再向甲烧杯中滴入几滴浓NaOH溶液,电流计指针再次发生偏转.下列判断不正确的是( ) 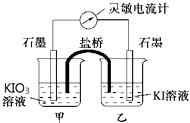
A.两次电流计指针偏转方向相反,电流计读数为零时,反应达到化学平衡状态
B.两次实验中,盐桥中的阳离子移动方向相反
C.开始加入少量浓硫酸时,只有乙烧杯中溶液变蓝
D.向甲烧杯中滴入几滴浓NaOH溶液后,乙中石墨电极上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有氢气与氯气的混合气体0.1mol,经充分反应后,通入60mL 2mol/L的NaOH溶液中,所得溶液中只含有2种溶质,其中NaCl为0.1mol.则原混合气体中氢气的物质的量可能是( )
A.0.03mol
B.0.04mol
C.0.05mol
D.0.06mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. NaHSO4能电离出H+,但NaHSO4不属于酸,而属于盐
B. 盐酸、浓硫酸都属于酸,也都属于化合物
C. Na2O、Na2O2,、CaO都溶于水生成碱,它们都属于碱性氧化物
D. Fe(OH)2、Fe(OH)3难溶于水,属于非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A. 强酸性溶液中:K+、Cu2+、NO3-
B. 强碱性溶液中:Na+、NH4+、Cl-
C. 含1 mol·L-1 NH3·H2O的溶液中:K+、Al3+、SO42-
D. 含1 mol·L-1 Fe3+的溶液中:H+、Na+、SCN-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用ClO2生产NaClO2并进行尾气处理的工艺如下:
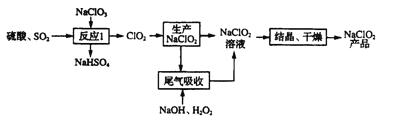
(1)写出“反应I”中生成ClO2的化学方程式:______
(2)“尾气吸收”是为了吸收未反应的ClO2,除减少污染外,还能______
(3)实验室用右图所示装置模拟“尾气吸收”过程,发现温度较低时吸收效果好,但该反应为放热反应。在不改变吸收液浓度和体积的条件下,欲使反应在0℃~5℃下进行,实验中可采取的措施有__________
(4)为了测定获得产品中NaClO2的纯度,进行如下实验:
①准确称取1.000g上述产品,溶于水配成100.00ml,的溶液。
②取10.00mL待测液,加入过量的KI溶液,在酸性条件下发生如下反应:ClO2+4I-+4H+==2H2O+2I2+Cl-,杂质不与I-反应。
③以淀粉作指示剂,再加入0.2000mol/L Na2S2O3溶液,恰好完全反应时消耗Na2S2O3,溶液的体积为20.00mL。(已知:I2+2S2O32-=2I-+S4O62-)。计算该样品中NaClO2的纯度______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH﹣):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3﹣、CO32﹣ , 现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( ) 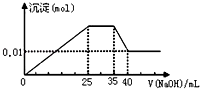
A.原溶液一定不存在H+、Cu2+、CO ![]()
B.不能确定原溶液是否含有K+、NO ![]()
C.原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D.实验所加的NaOH溶液浓度为2mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com