

分析 常温常压下,F为红棕色气体,为NO2,非金属性单质D与氧气反应得到E、E与氧气反应得到F,D为非金属气态单质,是大气中含量最多的物质,可推知D为N2,E为NO,F与水反应得到硝酸与NO,H为非金属固态单质,其原子核中有6个质子,H能与G反应得到二氧化氮与J,可推知H为碳,G为硝酸,J是无色气体,且能够使燃着的木条熄灭,J为CO2,由转化关系可知,I为NaHCO3,K为Na2CO3,A为金属单质,其氧化物具有两性,则A为Al,A与盐酸溶液反应得B为AlCl3,B中加入过量的氢氧化钠得C为NaAlO2,偏铝酸钠溶液与二氧化碳反应可以得到氢氧化铝沉淀,L为白色不溶于水的固体,它既能与盐酸反应又能与氢氧化钠反应,所以L为Al(OH)3,据此解答.
解答 解:常温常压下,F为红棕色气体,为NO2,非金属性单质D与氧气反应得到E、E与氧气反应得到F,D为非金属气态单质,是大气中含量最多的物质,可推知D为N2,E为NO,F与水反应得到硝酸与NO,H为非金属固态单质,其原子核中有6个质子,H能与G反应得到二氧化氮与J,可推知H为碳,G为硝酸,J是无色气体,且能够使燃着的木条熄灭,J为CO2,由转化关系可知,I为NaHCO3,K为Na2CO3,A为金属单质,其氧化物具有两性,则A为Al,A与盐酸溶液反应得B为AlCl3,B中加入过量的氢氧化钠得C为NaAlO2,偏铝酸钠溶液与二氧化碳反应可以得到氢氧化铝沉淀,L为白色不溶于水的固体,它既能与盐酸反应又能与氢氧化钠反应,所以L为Al(OH)3,
(1)根据上面的分析可知,C为NaAlO2,
故答案为:NaAlO2;
(2)I为NaHCO3,在生产生活中可以治疗胃酸过多、焙制糕点、灭火剂试剂等,
故答案为:治疗胃酸过多、焙制糕点、灭火剂试剂等;
(3)E为NO,E+氧气→F的化学方程式为2NO+O2=2NO2,
故答案为:2NO+O2=2NO2;
(4)A与稀盐酸反应的离子方程式为2Al+6H+=2Al3++3H2↑,
故答案为:2Al+6H+=2Al3++3H2↑.
点评 本题考查无机物的推断,F的颜色为解答本题的突破口,注意D单质连续氧化生成F及B沉淀能溶于碱即可解答,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
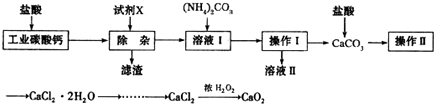
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 14 | B. | 13 | C. | 12 | D. | 无法计算 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
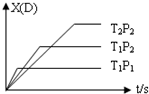 已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )
已知可逆反应 mA(g)+nB(g)?pC(g)+qD(g),反应中D的物质的量分数X(D)与时间t的关系如图,则下列叙述正确的是( )| A. | 正反应为放热反应 | B. | m+n>p+q | ||
| C. | T1<T2 | D. | P1<P2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②④⑤ | C. | ①⑤⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丁达尔现象可用来区别胶体与溶液 | |
| B. | 溶液、胶体、浊液的根本区别是分散质粒子直径的大小 | |
| C. | 胶体在一定条件下会发生聚沉 | |
| D. | 胶体粒子能通过半透膜,不能通过滤纸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改变某一条件,使v(正)、v(逆)均改变,化学平衡一定移动 | |
| B. | 改变某一条件,使v′(正)>v′(逆)不变,化学平衡一定逆向移动 | |
| C. | 改变某一条件,使v′(正)增大,v′(逆)不变,化学平衡一定正向移动 | |
| D. | 改变某一条件后,v′(正)、v′(逆)同时增大或同时减小时,化学平衡不移动 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com