
(6分)某种工业废水中含有一定量的Cr2O72-和CrO42-,它们易被人体吸收积累而导致肝癌。污水处理厂常用还原沉淀法处理含铬废水,其流程如下:
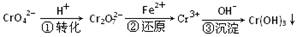
(1)已知第①步存在平衡:2CrO42—(黄色)+2H+ Cr2O72—(橙色)+H2O
Cr2O72—(橙色)+H2O
①Cr2O72-中Cr的化合价是 。
②若平衡体系的pH=10,则溶液显 色。
(2)第②步发生反应的离子方程式为 _______ ,还原1mol Cr2O72—离子,需要_______mol的FeSO4·7H2O;
(3)常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至 。
(1)① +6 (1分) ②黄(1分)
(2)6Fe2++ Cr2O72- + 14H+= 6Fe3++ 2Cr3+ + 7H2O (2分) 6 (1分) (3)5 (1分)
【解析】(1)①根据化合价的代数和为0可知,Cr的化合价是+(2×7-2)÷2=+6价。
②pH=10,说明溶液显碱性,平衡向逆反应方向移动,所以溶液显黄色。
(2)根据反应物可知,亚铁离子被氧化生成铁离子,所以方程式为6Fe2++ Cr2O72- + 14H+= 6Fe3++ 2Cr3+ + 7H2O。根据方程式可知,还原1mol Cr2O72—离子,需要6mol亚铁离子。
(3)根据溶度积常数表达式可知c(OH-)= ,所以pH应该调节至5。
,所以pH应该调节至5。


 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:吉林省长春市十一中2012届高三上学期期中考试化学试题 题型:058
Ⅰ.已知某工业废水中含有大量CuSO4,少量的Ag+、Hg2+以及部分污泥,通过下述过程可从该废水中回收硫酸铜晶体及其它物质.

(1)步骤1的主要操作是________,需用到的玻璃仪器除烧杯外有________.
(2)步骤2中需加入某种试剂后再将混合物分离,该试剂是(填化学式)________.
(3)步骤2中在分离Hg和固体残渣时,在封闭体系中加热、冷凝回收的方法,原因是________
(4)步骤3之后在B中加入液体混合物X(稀H2SO4和一种绿色氧化剂),仅生成硫酸铜溶液,无其它物质生成,反应方程式是________.
(5)步骤4中涉及的操作是:蒸发浓缩、________、过滤、烘干.
Ⅱ.在CuSO4溶液中加入适量KI溶液,有白色沉淀CuI生成,写出反应的离子方程式________.
现以下列电解池装置电解KI溶液:

请回答:电解开始不久时,电解池中的现象是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)下表是元索周期表前四周期的一部分,①〜⑤代表五种元素。
(1)⑤元素形成的一种离子在空气中很不稳定,写出此离子的核外电子排布式:______
(2) 标准状况下,①元素形成的气态氢化物与CO的密度相同,是一种高能燃料。1g该氢化物完全燃烧生成①的最高价氧化物(固态)和液态水放热72.35kJ。请写出该氢化物燃烧的热化学方程式:__________________。
(3) 染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加人③元素形成的单质除去。加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体。请写出相应的离子方程式:________________________。
(4) 分别写出含有④元素的某种18电子的微粒和含有②元素的某种10电子的离子间反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源:2012届安徽省皖南八校高三第一次联考化学试卷 题型:填空题
(10分)下表是元索周期表前四周期的一部分,①?⑤代表五种元素。
(1)⑤元素形成的一种离子在空气中很不稳定,写出此离子的核外电子排布式:______
(2) 标准状况下,①元素形成的气态氢化物与CO的密度相同,是一种高能燃料。1g该氢化物完全燃烧生成①的最高价氧化物(固态)和液态水放热72.35kJ。请写出该氢化物燃烧的热化学方程式:__________________。
(3) 染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加人③元素形成的单质除去。加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体。请写出相应的离子方程式:________________________。
(4) 分别写出含有④元素的某种18电子的微粒和含有②元素的某种10电子的离子间反应的离子方程式:__________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省皖南八校高三第一次联考化学试卷 题型:填空题
(10分)下表是元索周期表前四周期的一部分,①〜⑤代表五种元素。

(1)⑤元素形成的一种离子在空气中很不稳定,写出此离子的核外电子排布式:______
(2) 标准状况下,①元素形成的气态氢化物与CO的密度相同,是一种高能燃料。1g该氢化物完全燃烧生成①的最高价氧化物(固态)和液态水放热72.35kJ。请写出该氢化物燃烧的热化学方程式:__________________。
(3) 染料工业排放的废水中含有大量有毒的NO2-,可以在碱性条件下加人③元素形成的单质除去。加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体。请写出相应的离子方程式:________________________。
(4) 分别写出含有④元素的某种18电子的微粒和含有②元素的某种10电子的离子间反应的离子方程式:__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com