

分析 (1)标况下n(Cl2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据Cl原子守恒计算被氧化HCl的物质的量;
(2)Cl2和NaOH溶液反应生成NaCl、NaClO和水,锰离子被氯气氧化生成Mn2O3和盐酸;
(3)①酸性条件下,MnO2被还原生成 Mn2+,则甲物质作还原剂,具有还原性;含有锰离子的溶液中用电解法析出MnO2;也可以向溶液中加入NaClO3,锰离子被还原生成MnO2;
②根据转移电子守恒判断Cl元素产物,由转移电子守恒、元素守恒、原子守恒配平方程式.
解答 解:(1)标况下n(Cl2)=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据Cl原子守恒计算被氧化n(HCl)=2n(Cl2)=2×0.5mol=1mol,故答案为:1;
(2)Cl2和NaOH溶液反应生成NaCl、NaClO和水,离子方程式为Cl2+2OH-=Cl-+ClO-+H2O;锰离子被氯气氧化生成Mn2O3和盐酸,离子方程式为2 Mn2++Cl2+3H2O═Mn2O3+6 H++2Cl-,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;2 Mn2++Cl2+3H2O═Mn2O3+6 H++2Cl-;
(3)酸性条件下,MnO2被还原生成 Mn2+,则甲物质作还原剂,具有还原性;含有锰离子的溶液中用电解法析出MnO2;也可以向溶液中加入NaClO3,锰离子被还原生成MnO2;
①通过以上分析知,甲物质具有还原性,故选b;
②生成0.050molMnO2时,消耗0.10mol•L-1的NaClO3溶液200mL,n(NaClO3)=0.10mol/L×0.2L=0.02mol,根据Mn原子守恒得n(Mn2+)=n(MnO2)=0.05mol,转移电子物质的量=0.05mol×2=0.1mol,要转移0.1mol电子,则Cl元素化合价由+5价变为0价,所以生成氯气,n(Mn2+):n(NaClO3)=0.05mol:0.02mol=5:2,再结合原子守恒配平方程式为,故答案为:2ClO3-+5 Mn2++4H2O=5MnO2+Cl2↑+8H+.
点评 本题考查物质制备及氯气性质,为高频考点,侧重考查氧化还原反应、离子方程式的书写,难点是(3)题②产物的判断,注意原子守恒、转移电子守恒的运用,题目难度不大.


科目:高中化学 来源: 题型:解答题
 工业电解饱和食盐水模拟装置的结构如图所示:
工业电解饱和食盐水模拟装置的结构如图所示: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| B. | 向氢氧化钠溶液中通入二氧化碳:2OH-+CO2=CO32-+H2O | |
| C. | 澄清石灰水与稀盐酸反应:Ca (OH)2+2H+=Ca2++2H2O | |
| D. | 铁钉放入硫酸铜溶液中:Fe+3Cu2+=2Fe3++3Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.
某实验小组用0.50mol/L NaOH溶液和0.50mol/L硫酸溶液进行中和热的测定.| 实验次数] | 起始温度t1/°C] | 终止温度t2/°C] | 温度差平均值(t2-t1)/°C] | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 31.2 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
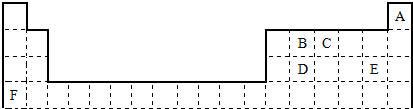
 .比较E、F的两种简单离子的半径大小:E-大于(填大于或小于)F+
.比较E、F的两种简单离子的半径大小:E-大于(填大于或小于)F+查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化亚铁在空气中的变化:4Fe(OH)2+2H2O+O2═4Fe(OH)3 | |
| B. | AlCl3溶液中加入过量的浓氨水:Al3++4NH3•H2O═AlO${\;}_{2}^{-}$+4NH4++2H2O | |
| C. | 向Ca(HCO3)2溶液中滴加过量的NaOH溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O | |
| D. | 用FeCl3溶液腐蚀铜线路板:Cu+Fe3+═Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a是电源的正极 | |
| B. | 电子流动的方向:d→b | |
| C. | c极发生氧化反应 | |
| D. | 如果将c、d两电极互换,则c上也会生成黄绿色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ②③④⑥⑦ | C. | ②③④⑥ | D. | ②③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com