
(12分)根据下列某些短周期元素中元素性质回答问题。
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ |
原子半径/10 -10m | 0.37 | 1.86 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.52 | 0.75 | 0.71 |
最高价态 | +1 | +1 |
| +3 | +4 | +5 | +7 | +1 | +5 |
|
最低价态 | -1 |
| -2 |
| -4 | -3 | -1 |
| -3 | -1 |
(1)元素③、⑥和⑨的氢化物中沸点由高到低的顺序是__________ (填化学式)。
(2)元素①和⑨形成阳离子 ,其结构式为__________________。
(3)某元素R的原子半径为1.02×10 -10m ,它与钠形成Na2R2,其电子式是_________(R用元素符号表示)。
(4)元素②和⑦形成晶体的部分结构可用下图中的_________来表示(填序号)。

(5)①、③、⑨可以形成原子个数之比为4:3:2的中学常见无机化合物,该化合的水溶液显酸性的原因是_________________(用离子方程式表示),其水溶液中离子浓度由大到小的顺序是___________________。
(1)H2O、NH3、PH3 ; (2)  (3)
(3) (4) A
(4) A
(5) NH4+ + H2O  NH3.H2O + H+ ; C(NO3--) > C(NH4+) > C( H+) > C(O H--)
NH3.H2O + H+ ; C(NO3--) > C(NH4+) > C( H+) > C(O H--)
【解析】
试题分析:根据搞个的数据经方向可得:①是H;②是Na;③是O;④是Al;⑤是C;⑥是P;⑦是Cl;⑧是Na;⑨是N;⑩是F。(1)元素③、⑥和⑨的氢化物分别是H2O、PH3、 NH3;元素的非金属性O>N>P,这几种物质都是分子晶体。分子间通过分子间作用力结合。由于在H2O、NH3的分子之间除了存在分子间作用力外还存在氢键,增加了分子之间的相互作用,所以沸点最低的是PH3。由于O元素的非金属性比N强,所以H2O的氢键也强于NH3。因此三种物质中沸点由高到低的顺序是H2O> NH3>PH3。(2)元素H和N可形成阳离子NH4+ ,其结构式为 ;(3)某元素R的原子半径为1.02×10 -10m,介于P与Cl原子半径之间,所以该元素是S。所以它与钠形成Na2S2的电子式是
;(3)某元素R的原子半径为1.02×10 -10m,介于P与Cl原子半径之间,所以该元素是S。所以它与钠形成Na2S2的电子式是 ;(4)元素Na和Cl形成NaCl晶体是离子晶体。阳离子与阴离子的配位数但是6个。其结构可用A表示。(5)H、O、N可以形成原子个数之比为4:3:2的中学常见无机化合物是NH4NO3,该物质是强酸弱碱盐,铵根离子水解消耗水电离产生的OH-,使溶液中的H+浓度增大,因此溶液显酸性。水解的离子方程式为NH4+ + H2O
;(4)元素Na和Cl形成NaCl晶体是离子晶体。阳离子与阴离子的配位数但是6个。其结构可用A表示。(5)H、O、N可以形成原子个数之比为4:3:2的中学常见无机化合物是NH4NO3,该物质是强酸弱碱盐,铵根离子水解消耗水电离产生的OH-,使溶液中的H+浓度增大,因此溶液显酸性。水解的离子方程式为NH4+ + H2O  NH3.H2O + H+ ; NH4NO3= NH4+ + NO3--。铵根离子水解消耗,所以C(NO3--) > C(NH4+);由于水解消耗了OH-,最终溶液中的H+浓度大于OH-的浓度。即C( H+) > C(O H--);盐的电离远大于弱电解质水的电离。因此C(NH4+) > C( H+)。综上所述,在溶液中离子浓度的关系是C(NO3--) > C(NH4+) > C( H+) > C(O H--)。
NH3.H2O + H+ ; NH4NO3= NH4+ + NO3--。铵根离子水解消耗,所以C(NO3--) > C(NH4+);由于水解消耗了OH-,最终溶液中的H+浓度大于OH-的浓度。即C( H+) > C(O H--);盐的电离远大于弱电解质水的电离。因此C(NH4+) > C( H+)。综上所述,在溶液中离子浓度的关系是C(NO3--) > C(NH4+) > C( H+) > C(O H--)。
考点:考查元素的推断、物质的熔沸点的比较、电子式和结构式的书写、离子浓度的比较的知识。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2013-2014陕西省富平县高二下学期期末考试化学试卷(解析版) 题型:选择题
由乙醛和乙酸乙酯组成的混合物中,若含碳的质量分数为A%,则此混合物中含氢的质量分数为
A.6A% B.A/6% C.10A% D.(100-7A/6)%
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高二化学试卷(解析版) 题型:选择题
下列有关化学用语的表示方法中正确的是( )
A.氯元素的原子结构示意图: B.N2的结构式:N≡N
B.N2的结构式:N≡N
C.原子核内有8个中子的氧原子: D.二氧化碳的电子式:
D.二氧化碳的电子式: 
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高一化学试卷(解析版) 题型:选择题
下列过程中没有破坏化学键的是( )
A.氯化氢溶于水 B.氯化铵分解 C.食盐熔化 D.干冰升华
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市下学期期中考试高一化学试卷(解析版) 题型:选择题
元素周期表和元素周期律对与化学相关的科学技术具有指导作用,人们常在元素周期表中一定的区域内寻找特殊物质,其中寻找催化剂的区域为( )
A.金属与非金属的分界线附近区域 B.过渡元素区域
C.氟、氯、硫、磷等元素附近区域 D.元素周期表左下部分主族元素区域
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市名校联盟高三三诊理综化学试卷(解析版) 题型:填空题
(14分)元素及其化合物在生产、生活中具有广泛的用途。
Ⅰ.铬化学丰富多彩:
⑴在常温下,铬能缓慢与稀硫酸反应,生成蓝色溶液。与铜相比,其金属活泼性 。(填“强”或“弱”)
⑵Cr( OH)3和Al( OH)3类似,也是两性氢氧化物,在水中存在酸式和碱式电离平衡,其酸式电离方程式是 。
(3)工业上净化处理铬污染方法之一:将含K2Cr2O7酸性废水放入电解槽内,加入适量的NaCl,以Fe和石墨为电极进行电解。一段时间后,生成Cr(OH)3和Fe(OH)3沉淀除去(已知Ksp[ Fe(OH)3]=4.0×10-38,Ksp[Cr(OH)3]=6.0×l0-31)。已知电解后的溶液中c( Fe3+)为2.0×10-13mol/L,则溶液中c(Cr3+)为 mol/L。
Ⅱ.物质A~H有如图所示转化关系(部分生成物未列出)。A、E、F、G均为气体,D为贵重金属之一。

请回答下列问题:
(1)A分子是 分子(填“极性”或“非极性”),C溶液中的阳离子是 (写化学式,不考虑水的电离)。
(2)反应①的化学方程式为 ;反应③的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市高三5月月考理综化学试卷(解析版) 题型:选择题
下列推论正确的是:
A.S(g)+O2(g)==SO2(g)△H1;S(s)+O2(g)==SO2(g) △H2,则:△H1>△H2
B.C(石墨,s)=C(金刚石,S)△H=+1.9 kJ/mol,则由石墨制取金刚石的反应是吸热反应,金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(I)△H=﹣57.4 kJ/mol,则:含20 gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7 kJ
D.2C(s)+O2(g)=2CO(g)△H=﹣221 kJ/mol,则碳的燃烧热等于110.5kJ/mol
查看答案和解析>>
科目:高中化学 来源:2013-2014重庆市万州区高三考前模拟理综化学化学试卷(解析版) 题型:选择题
某小分子抗癌药物的分子结构如图所示,下列说法正确的是
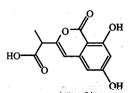
A.1mol该有机物最多可以和5mol NaOH反应
B.该有机物容易发生加成、取代、中和、消去等反应
C.该有机物遇FeCl3溶液不变色,但可使酸性KMnO4溶液褪色
D.1mol该有机物与浓溴水反应,最多消耗3mol Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com