
| A. | CH4 | B. | C2H4 | C. | C4H6 | D. | C6H6 |
分析 由C~O2~CO2,4H~O2~2H2O进行比较,消耗1molO2,需要12gC,而消耗1molO2,需要4gH,可知有机物含氢量越大,等质量时消耗的O2越多,以此进行比较.
解答 解:由C~O2~CO2,4H~O2~2H2O进行比较,消耗1molO2,需要12gC,而消耗1molO2,需要4gH,可知有机物含氢量越大,等质量时消耗的O2越多,
则选项中物质的最简式分别为CH4、CH2、CH1.5、CH1.1,
由最简式CHn中n值越大,含氢量越高,所以根据烃分子的化学式可知,完全燃烧消耗O2的物质的量最少的应该是C6H6,
故选D.
点评 本题考查有机物烃分子燃烧的有关计算,题目难度不大,侧重学生对烃分子燃烧规律的熟悉掌握程度,以及灵活运用基础知识解决实际问题的能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:实验题
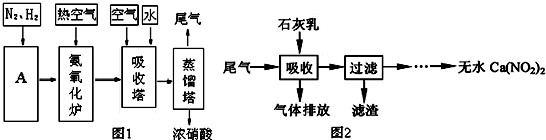
 CO+3H2.
CO+3H2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
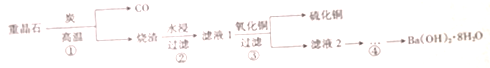
| A. | 步骤①中BaSO4作氧化剂 | |
| B. | 步骤②所得滤液1呈中性 | |
| C. | 步骤③中发生复分解反应 | |
| D. | 步骤④的实验操作中不需要用到石棉网、坩埚 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(C)<r(D)<r(B) | |
| B. | 元素A与B只能形成一种化合物 | |
| C. | A的简单气态氢化物的热稳定性比C的强 | |
| D. | C的最高价氧化物的水化物的酸性比D的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca(HCO3)2(aq)与Ca(OH)2(aq) | B. | Ca(HCO3)2(aq)与NaOH(aq) | ||
| C. | NaHCO3 (aq)与Ca(OH)2(aq) | D. | Mg(HCO3)2(aq)与NaOH (aq) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
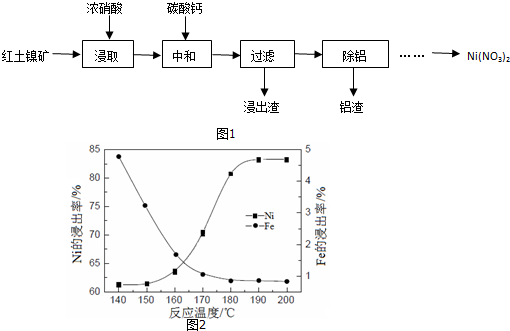
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com