
【题目】碘及其化合物主要用于医药、照相及染料等。碘是合成碘化物的基本原料。
(一) 实验室测定KI溶液中I-的含量
量取25.00mLKI溶液溶液于250mL锥形瓶中,分别加入少量稀H2SO4和稍过量的NH4Fe(SO4)2·12H2O溶液,摇匀。小火加热蒸发至碘完全升华,取下锥形瓶冷却后,加入稀H2SO4,再加入几滴二苯胺磺酸钠(用作指示剂,被强氧化剂氧化为紫色),用0.0250mol·L-1标准K2Cr2O7溶液进行滴定至终点。重复3次,平均每次消耗K2Cr2O7溶液20.00mL(已知反应:①2Fe3++2I-=2Fe2++I2 ②6Fe2++Cr2O72-+14H+==6Fe3++2Cr3++7H2O
(1)在滴定过程中,下列操作(其他操作正确)会造成测定结果有误差的是_________________。
A.终点读数时俯视读数,滴定前平视读数
B.锥形瓶水洗后未干燥
C.滴定管未用标准K2Cr2O7溶液润洗
D.盛标准K2Cr2O7溶液的滴定管,滴定前有气泡,滴定后无气泡
(2)该实验达到滴定终点时,现象为__________________。
(3)根据滴定有关数据,该KI溶液中I-含量是________g·L-1。
(二) 某实验小组认为氧气可以氧化KI 溶液中的I-,其做了下列实验探究影响该反应的因素。
实验 | 气体a | 编号及现象 |
| 空气(含HCl) | Ⅰ.溶液迅速呈黄色 |
空气(含CO2) | Ⅱ.长时间后,溶液呈很浅的黄色 | |
空气 | Ⅲ.长时间后,溶液无明显变化 |
(4)装置A (含导管)的名称为_________________。
(5)通入a为空气(含HCl)时,发生反应的离子方程式为______________________。
(6)实验Ⅲ的作用是________________________。
(7)用CCl4萃取Ⅰ、Ⅱ、Ⅲ的溶液,萃取后下层溶液的颜色均无色。取萃取后上层溶液,用淀粉检验:Ⅰ、Ⅱ的溶液变蓝;Ⅲ的溶液未变蓝。溶液变蓝说明Ⅰ、Ⅱ中生成了__________________________。
(8)查阅资料: I2易溶于KI 溶液。下列实验证实了该结论并解释Ⅰ、Ⅱ的萃取现象。

现象X是_____。用KI萃取Ⅰ、Ⅱ的溶液,萃取后下层溶液颜色均无色的原因是_________________。
(9)综合实验证据说明影响I-被氧化的因素及对应关系:__________________________。
【答案】 ACD 溶液恰好变为紫色 15.24 洗气瓶 O2 +4I-+4H+= I2+2H2O 对照组,证明只有氧气时很难氧化I- I2 溶液分层,上层黄色,下层无色 I2在KI溶液中的溶解度大于在CCl4中的溶解度 与c(H+)有关,c(H+)越大,I-越易被氧化
【解析】考查实验方案设计与评价,(1)A、所读体积比实际小,计算出的结果偏小,故A正确;B、锥形瓶中是否干燥,对所测值无影响,故B错误;C、滴定管未用标准液润洗,标准液的浓度偏低,消耗标准液的体积增多,即所测浓度偏高,故C正确;D、滴定前有气泡,滴定后气泡消失,所用标准液的体积偏大,所测浓度偏高,故D正确;(2)根据实验操作步骤,滴定终点时的现象是溶液恰好变为紫色,且30s内不恢复原来的颜色;(3)根据反应方程式,建立关系式为6I-~6Fe2+~Cr2O72-,则I-的含量为 g·L-1=15.24g·L-1;(4)装置A为洗气瓶;(5)溶液迅速呈黄色,说明产生了I2,I-被空气中氧气氧化成I2,因此离子反应方程式为O2 +4I-+4H+= I2+2H2O;(6)三组中都含有空气,实验III中不含HCl和CO2,因此实验III的目的是对照组,证明只有氧气时很难氧化I-;(7)淀粉与碘单质变蓝,说明I、II产生I2;(8)I2易溶于KI,且KI不溶于CCl4,现象X为溶液分层,上层黄色,下层无色;I2在KI溶液中的溶解度大于在CCl4中的溶解度;(8)HCl水溶液显酸性,酸性较强,迅速出现黄色,CO2属于酸性氧化物,碳酸属于弱酸,长时间后,得到黄色溶液,而实验III无明显变化,说明影响I-被氧化,与c(H+)有关,c(H+)越大,I-越容易被氧化。
g·L-1=15.24g·L-1;(4)装置A为洗气瓶;(5)溶液迅速呈黄色,说明产生了I2,I-被空气中氧气氧化成I2,因此离子反应方程式为O2 +4I-+4H+= I2+2H2O;(6)三组中都含有空气,实验III中不含HCl和CO2,因此实验III的目的是对照组,证明只有氧气时很难氧化I-;(7)淀粉与碘单质变蓝,说明I、II产生I2;(8)I2易溶于KI,且KI不溶于CCl4,现象X为溶液分层,上层黄色,下层无色;I2在KI溶液中的溶解度大于在CCl4中的溶解度;(8)HCl水溶液显酸性,酸性较强,迅速出现黄色,CO2属于酸性氧化物,碳酸属于弱酸,长时间后,得到黄色溶液,而实验III无明显变化,说明影响I-被氧化,与c(H+)有关,c(H+)越大,I-越容易被氧化。


科目:高中化学 来源: 题型:
【题目】有机物E是医药合成中间体。其合成路线如下:

(1)![]() 的官能团名称为_____________。E的分子式为_______________。
的官能团名称为_____________。E的分子式为_______________。
(2)B→D的过程中,B分子的羧基全部酯化,写出该反应方程式:_________________。
(3)D→E的反应历程如下:

写出反应Ⅱ、Ⅲ的反应类型:Ⅱ_____________、Ⅲ_____________
(4)写出满足下列条件的A的所有同分异构体的结构简式___________________。
a.能与新制氢氧化铜悬浊液反应产生砖红色沉淀
b.常温下能与Na2CO3反应并释放出气体
(5)请写出以CH2=CH2为主要原料(无机试剂任用)制备OHC—CHO(乙二醛)的合成路线流程图(须注明反应条件)_______。(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如右图所示。

若“重整系统”发生的反应中![]() =6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
=6,则FexOy的化学式为_________________,“热分解系统”中每分解lmolFexOy,转移电子的物质的量为________________________。
(2)二氧化碳催化加氢合成低碳烯烃是目前研究的热门课题。
在一个2L密闭恒容容器中分别投入1.5molCO2、5.0molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。
C2H4(g)+4H2O(g) ΔH;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如右图所示。

①该反应的ΔH_________0 (填“>”“<”或“不能确定”);
②在TA温度下的平衡常数K=__________________。
③提高CO2的平衡转化率,除改变温度外,还可采取的措施是:_______________________ (列举一项)。
④在TA温度下,其他条件不变,起始时若按1molCO2、2molH2、 lmolC2H4(g)、2molH2O(g)进行投料,此时v(正)________v(逆)。(填“>”“<”或“=”)。
(3) 用氨水吸收CO2制化肥碳铵(NH4HCO3)。
①已知:NH3·H2O(aq)![]() NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
NH4+(aq)+OH-(aq) ΔH1= a kJ/mol
CO2(g)+H2O(1)![]() H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq) ΔH2= b kJ/mol
H2CO3(aq)+OH-(aq)![]() HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
HCO3-(aq) +H2O(1) ΔH3= c kJ/mol
则利用NH3·H2O吸收CO2制备NH4HCO3的热化学方程式为____________________________;
②己知常温下相关数据如表:
Kb(NH3·H2O) | 2×10-5 |
Ka1(H2CO3) | 4×10-7 |
Ka2(H2CO3) | 4×10-11 |
则反应NH4++ HCO3-+H2O![]() NH3·H2O +H2CO3的平衡常数K=________________。
NH3·H2O +H2CO3的平衡常数K=________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以异丁烯为原料合成某二酸的合成路线如下:

已知:R-CH2CN![]() R-CH2COONa+NH3
R-CH2COONa+NH3
(1)A的系统命名是_______________,B的官能团名称是_______________________。
(2)步骤③的反应类型是____________________________。
(3) 同一有机物中的两个同种官能团在反应时,一者参与反应占绝大多数,另一者几乎不反应,这被称之为“位置专一性”。请从反应物结构角度,简要解释步骤②中消去氯原子时的位置专一性:______________________________。
(4)步骤⑤的产物C经酸化后,可发生分子内酯化,写出该内酯的结构简式______________________。
(5)写出步骤⑥的化学方程式___________________________________。
(6)均符合下列条件B的同分异构体有________个。
a.所有碳原子一定共平面; b.核磁共振氢谱有3 组峰。
(7)利用题目给的信息,写出由异丁烯为原料,两步合成 的路线流程______。
的路线流程______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一容积为1L的密闭容器内加入0.1mol的N2和0.3mol的H2 , 在一定条件下发生如下反应:N2(g)+3H2(g)2NH3(g)△H<0,反应中NH3的物质的量浓度的变化情况如图: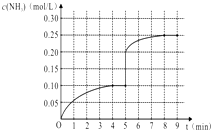
(1)该反应的化学平衡常数表达式为;
(2)根据如图,计算从反应开始到平衡时(4分钟末),平均反应速率v(N2)= .
(3)该反应达到平衡状态的标志是(填字母);
a.N2和NH3浓度相等
b.NH3百分含量保持不变
c.容器中气体的压强不变
d.3v正(H2)=2v逆(NH3)
e.容器中混合气体的密度保持不变
(4)在第5分钟末改变某一条件后,在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L),达到新平衡时NH3浓度的变化曲线如上图.则第5分钟末改变的条件是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是半导体光电化学电池光解水制氢的反应原理示意图。在光照下,电子由价带跃迁到导带后,然后流向对电极。下列说法不正确的是

A. 对电极的电极反应式为:2H++2e-=H2↑
B. 半导体电极发生还原反应
C. 电解质溶液中阳离子向对电极移动
D. 整个过程中实现了太阳能→电能→化学能的转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是
A. 常温常压下,28g乙烯含有碳原子数为2NA
B. 标准状况下,22.4L乙醇中所含有的分子数为NA
C. 1.8g![]() 与D2O的混合物中含有的质子数和电子数均为NA
与D2O的混合物中含有的质子数和电子数均为NA
D. 一定条件下,密闭容器中2molSO2(g)与1molO2(g)充分反应,则容器中分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学反应可以为人类提供能源,也可用来解决环境问题。
(1)已知某些化学键的键能数据如下:
化学键 | H-H | O=O | O-H |
键能kJ·mol-1 | 436 | 495 | 463 |
①写出H2与O2反应生成水蒸气的热化学方程式____________;
②利用该反应设计成燃料电池,已知该电池每发1kW·h电能生成360g水蒸气,则该电池的能量转化率为_____%(结果保留三位有效数字)。
(2)三室式电渗析法可以处理含K2SO4的废水,原理如图所示,两极均为惰性电极,ab为阳离子交换膜,cd为阴离子交换膜。

①阴极区的pH______(填“升高”或“降低”);
②阳极发生的电极反应式为__________;
③当电路中通过1mol电子的电量时,阴极上生成气体的体积为_____L(标准状况)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com