
(10分)羟基亚乙基二磷酸(HEDPA,结构式如右图,可简写为H4L)可在较宽的pH范围内与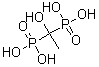 金属离子或原子形成稳定的配合物,是一种常用的配体,主要用作工业循环冷却水的缓蚀阻垢剂和无氰电镀的络合剂,与188Re所形成的188Re-HEDPA可用于治疗转移性骨癌。HEDPA和Mn2+可在一定的pH值和Mn2+/HEDPA配比下形成配合物A,将该配合物加热,在250℃以上样品失重25.80%。脱水结束后对残余物之进行元素分析。配合物A的元素含量为:Mn(15.74%);C(6.88%);H(4.62%);O(55.01%);P(17.77%)。 问:
金属离子或原子形成稳定的配合物,是一种常用的配体,主要用作工业循环冷却水的缓蚀阻垢剂和无氰电镀的络合剂,与188Re所形成的188Re-HEDPA可用于治疗转移性骨癌。HEDPA和Mn2+可在一定的pH值和Mn2+/HEDPA配比下形成配合物A,将该配合物加热,在250℃以上样品失重25.80%。脱水结束后对残余物之进行元素分析。配合物A的元素含量为:Mn(15.74%);C(6.88%);H(4.62%);O(55.01%);P(17.77%)。 问:
4-1 根据元素分析数据,推证配合物A的分子式为_______________________________
4-2 画出该配合物的结构示意图,并在图上注明HEDPA中哪些原子可为配位原子?(用*表示)
4-3 实验测得配合物A的磁矩为6.12 μ0,配合物未成对电子数为________,中心原子的杂化轨道类型是______________________________________________
4-4 如何将合成A的条件作修改,可得到多核配合物?并写出2种该多核配合物的分子式。
___________________________________________________________________________
___________________________________________________________________________
4-5 已知配合物[Mn(H2O)6]2+的d-d跃迁在400 nm -550 nm范围内有弱的吸收,配合物呈肉粉色;在水溶液中形成配合物Ⅱ后,中心离子的晶体场分裂能将发生怎样的变化?观察配合物的颜色明显加深,为什么?
___________________________________________________________________________
___________________________________________________________________________
![]() 4-1 MnC2H6O7P2?5H2O (2分)
4-1 MnC2H6O7P2?5H2O (2分)
![]() 4-2
4-2  (结构图1分,两个*各0.5分,共2分)
(结构图1分,两个*各0.5分,共2分)
![]() 4-3 由μ = [n(n+2)]1/2μ0 = 6.12 μ0
4-3 由μ = [n(n+2)]1/2μ0 = 6.12 μ0
![]() 得μ = [n(n+2)]1/2 = 6.12,→ n2 +2n -37.45 = 0
得μ = [n(n+2)]1/2 = 6.12,→ n2 +2n -37.45 = 0
![]() →(n-5.2) (n+7.2) = 0 → n = 5.2 → n≈5
→(n-5.2) (n+7.2) = 0 → n = 5.2 → n≈5
![]() 4-4 当[Mn2+] 》[H4L]时,可形成多核配合物,如[(H2O)5Mn H2L Mn(H2O)5]2+;
4-4 当[Mn2+] 》[H4L]时,可形成多核配合物,如[(H2O)5Mn H2L Mn(H2O)5]2+;
![]() [(Mn?5H2O)4L]4+等 (2分)
[(Mn?5H2O)4L]4+等 (2分)
![]() 4-5 由于HEDPA中磷酸基上的氧比水分子中的氧更易给出孤电子对,对中心离子d轨道的影响更大,因此形成配合物Ⅱ后,中心离子的晶体场分裂能将增加 (1分)
4-5 由于HEDPA中磷酸基上的氧比水分子中的氧更易给出孤电子对,对中心离子d轨道的影响更大,因此形成配合物Ⅱ后,中心离子的晶体场分裂能将增加 (1分)
由于水合离子的摩尔吸收率一般都很低,因此水合配合物的颜色常常较浅。当形成配合物Ⅱ后,d-d跃迁禁阻部分解除,摩尔吸收率增加,吸收颜色加深 (1分)


湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com