
【题目】写出以下实验的实验现象:
(1)向盛有FeCl3溶液的试管中加入KSCN溶液。____
(2)将密封有NO2的玻璃球浸泡在热水中。________
(3)向酸性高锰酸钾溶液中加入草酸溶液。______________
【答案】溶液变成红色 颜色加深 溶液褪色
【解析】
实验室常用KSCN溶液检验Fe3+的存在;在有NO2的环境中,存在2NO2(g)![]() N2O4(g)的平衡体系;草酸具有还原性,能被高锰酸钾酸性溶液氧化。
N2O4(g)的平衡体系;草酸具有还原性,能被高锰酸钾酸性溶液氧化。
(1)向盛有FeCl3溶液的试管中加入KSCN溶液,发生反应FeCl3+3KSCN==Fe(SCN)3+3KCl,Fe(SCN)3溶液呈红色,所以看到的现象是溶液变成红色。答案为:溶液变成红色;
(2)NO2为红棕色气体,N2O4为无色气体,将密封有NO2的玻璃球浸泡在热水中,能使平衡2NO2(g)![]() N2O4(g) H<0逆向移动,从而增大c(NO2),气体的颜色加深。答案为:颜色加深;
N2O4(g) H<0逆向移动,从而增大c(NO2),气体的颜色加深。答案为:颜色加深;
(3)向酸性高锰酸钾溶液中加入草酸溶液,发生反应2![]() +5
+5![]() +16H+═10CO2↑+2Mn2++8H2O,可以看到溶液褪色。溶液褪色。
+16H+═10CO2↑+2Mn2++8H2O,可以看到溶液褪色。溶液褪色。


科目:高中化学 来源: 题型:
【题目】健康人体内含铁元素大约2~3g,人体内铁元素以亚铁离子和三价铁离子的形式存在,Fe2+易被吸收,所以给贫血者补充铁元素时,应补充含Fe2+的亚铁盐。“速力菲”(主要成分:琥珀酸亚铁,呈暗黄色)是市场上一种常见的补铁药物。该药品不溶于水但能溶于人体中的胃酸。某同学为了检测“速力菲”药片中Fe2+的存在,设计并进行了如下实验:

(1)试剂1的名称是__,试剂2的名称是__。
(2)加入新制氯水,溶液中发生反应的离子方程式是__。
(3)加入试剂2时溶液为淡红色说明“速力菲”中的Fe2+已部分氧化,一般在服用“速力菲”时,同时服用维生素C,说明维生素C具有__性。
(4)不仅溶液中Fe2+易被氧化成Fe3+,溶液中白色沉淀Fe(OH)2更易被O2氧化,请写出反应的化学方程式___,现象为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是()
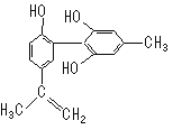
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.1 mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为3mol、7 mol
D.该分子中的所有碳原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸广泛应用在稀有金属的湿法冶金、漂染工业、金属加工、无机药品及有机药物的生产等领域中。HCl极易溶于水,工业上用HCl气体溶于水的方法制取盐酸。
(1)用密度为1.2g/mL,质量分数为36.5%的浓盐酸配制250mL3mol/L的稀盐酸,需要用量筒量取浓盐酸的体积为__mL。
(2)溶液配制中需要的玻璃仪器有烧杯、玻璃棒、量筒、__、__。
(3)实验过程中,下列操作会导致最终所配溶液浓度偏高的是__。
A.量取浓盐酸时俯视刻度线
B.实验前,容量瓶中有少量残留蒸馏水
C.定容时俯视刻度线
D.转移时,未洗涤烧杯和玻璃棒
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应A2(g)+2B2(g)=2AB2(g)(A2、B2、AB2的结构式分别为 A===A、B—B、B—A—B),能量变化如图所示,下列有关叙述中正确的是( )

A. 该反应的进行一定需要加热或点燃条件
B. 该反应若生成2molAB2(g)则放出的热量为 (E1-E2) kJ
C. 该反应断开化学键消耗的总能量大于形成化学键释放的总能量
D. 生成2 mol B—A键放出E2 kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烷(C8H10)可生产塑料单体苯乙烯(C8H8),其反应原理是C8H10(g)![]() C8H8(g)+H2(g) ΔH=+125kJ·mol-1
C8H8(g)+H2(g) ΔH=+125kJ·mol-1
Ⅰ.某温度下,将0.40mol苯乙烷,充入2L真空密闭容器中发生反应,测定不同时间该容器内物质的量,得到数据如下表:
时间/min | 0 | 10 | 20 | 30 | 40 |
n(C8H10)/mol | 0.40 | 0.30 | 0.26 | n2 | n3 |
n(C8H8)/mol | 0.00 | 0.10 | n1 | 0.16 | 0.16 |
(1)该温度下,该反应的化学平衡常数K=________________。
(2)若保持其他条件不变,用0.40molH2(g)和0.40molC8H8(g)合成C8H10(g),当有30kJ热量放出时,该反应中H2的转化率是________________,通过计算说明此时,该反应是否达到了平衡状态__________?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措施之一。
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有![]() ,其原因是_______________________________。
,其原因是_______________________________。
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如题20图- 1和题20图- 2所示。

①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为__________________。
②H3AsO4第一步电离方程式H3AsO4![]() H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=______(p Ka1 = -lg Ka1 )。
(3)溶液的pH对吸附剂X表面所带电荷有影响。pH =7.1时, 吸附剂X表面不带电荷; pH > 7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多。pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如题20图-3所示。

①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是______________。
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为___________。 提高吸附剂X对三价砷去除效果可采取的措施是_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各说法中,正确的是( )
A.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
B.雪是冬之精灵,在雪![]() 水
水![]() 冰的转化中能量变化。ΔH1>0,ΔH2<0
冰的转化中能量变化。ΔH1>0,ΔH2<0
C.1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热量叫做中和热
D.1 mol H2与0.5 mol O2反应放出的热量就是H2的燃烧热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在某一容积为2 L的密闭容器中,A、B、C、D四种物质的物质的量n(mol)随时间t(min)的变化曲线如图所示:

完成下列问题:
(1)该反应的化学方程式为_____________________。
(2)前2 min用A的浓度变化表示的化学反应速率为______________。
在2 min时,图像发生改变的原因可能是________(用字母表示)。
A.增大压强 B.降低温度
C.加入催化剂 D.增加A的物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com