
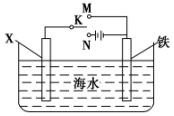
 利用如图装置,可以模拟铁的电化学防护.
利用如图装置,可以模拟铁的电化学防护.分析 若X为铜,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe连接电源的负极;若X为锌,开关K置于M处,形成原电池,Zn为负极被腐蚀,Fe为正极被保护.
解答 解:若X为铜,由于Fe比较活泼,为减缓铁的腐蚀,应使Fe为电解池的阴极,故K连接N处,铁棒为阴极,发生的电极反应为2H++2e-=H2↑,该种防护方法称为外接电源的阴极保护法;
若X为锌,开关K置于M处,Zn为负极被腐蚀,Fe为正极被保护,正极反应为:O2+4e-+2H2O=4OH-,该防护法称为牺牲阳极的阴极保护法;
故答案为:N;2H++2e-=H2↑;外接电源的阴极保护法;M;O2+4e-+2H2O=4OH-;牺牲阳极的阴极保护法.
点评 本题考查原电池知识,侧重于金属的腐蚀与防护的考查,为高频考点,注意把握原电池、电解池的工作原理以及金属的防护方法,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液中含有的阴、阳离子总数为共0.6 mol | |
| B. | 在0.5L该溶液中,Ba2+的浓度为0.1 mol/L | |
| C. | 在500 mL该溶液中,含有0.2 mol NO3- | |
| D. | 取1L该溶液稀释到10L时,NO3-的浓度为0.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.086 | 0.102 | 0.074 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
| A. | L、M、R、T形成的简单离子的半径最大的是L | |
| B. | 单质与等浓度等体积的稀盐酸反应的速率为Q>L | |
| C. | 气态氢化物稳定性:R>T | |
| D. | M与T形成的化合物既能与强酸反应又能与强碱反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷的主要成分属于硅酸盐 | |
| B. | 青铜的熔点比组份金属铜和锡都高 | |
| C. | 利用SO2漂白纸张时只发生了物理变化 | |
| D. | 黑火药反应2KNO3+S+3C=K2S+N2↑+3CO2↑中,氧化剂只有KNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8.4gNaHCO3晶体中含有0.1NA个CO32- | |
| B. | 常温常压下,32g臭氧所含的氧原子数为2NA | |
| C. | 0.1molFe与过量硝酸反应,转移电子数为0.2NA | |
| D. | 1molCH4与1molCl2在光照下反应,生成CH3Cl的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加少量水 | B. | 加少量NaOH固体 | C. | 加少量浓氨水 | D. | 通入少量HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
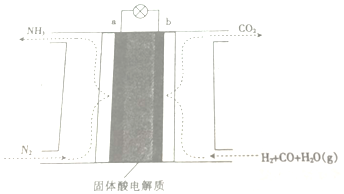
| A. | 放电时,b极表面H2与CO均被氧化 | |
| B. | 该电池工作时,H+由b极区迁移至a极区 | |
| C. | a极的电极反应为N2+6H++6e-=2NH3 | |
| D. | 工作一段时间后b极附近的PH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

| 操 作 | 现 象 |
| 取0.1mol/L的FeBr2溶液100mL,测溶液的pH | pH试纸变红(约为4) |
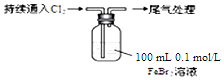 | ⅰ.开始通入100mLCl2(折合标准状况),溶液由浅绿色逐渐变黄; ⅱ.稍后,继续通入Cl2,溶液黄色加深,变为棕黄色; iii.稍后,溶液由棕黄色变浅,最终变为黄色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com