
【题目】某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42ˉ。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如图所示的流程图:
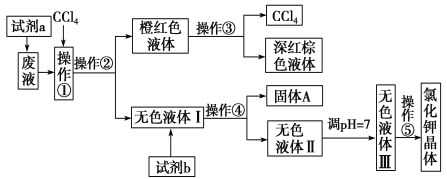
可供试剂a、试剂b(试剂b代表一组试剂)选择的试剂:饱和Na2CO3溶液、饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、酸性KMnO4溶液、稀盐酸。
请根据流程图,回答相关问题:
(1) 操作①②③④⑤的名称是_____________
①_______②________③________④________⑤________
(2) 除去无色液体Ⅰ中的Ca2+、Mg2+、SO42ˉ,选出试剂b所代表的试剂,按滴加顺序依次是________________(填化学式)。
(3)调节pH的目的是____________________,操作方法是_______________________。
(4)操作⑤中用到的瓷质仪器名称是 。
【答案】(1)①萃取②分液③蒸馏④过滤⑤蒸发;
(2)BaCl2、K2CO3、KOH(或KOH、BaCl2、K2CO3或BaCl2、KOH、K2CO3);
(3)除去过剩的OH-及CO![]() ;滴加稀盐酸,无气体产生时,用pH试纸测定至溶液的pH=7;
;滴加稀盐酸,无气体产生时,用pH试纸测定至溶液的pH=7;
(4)蒸发皿
【解析】
试题分析:(1)根据流程图可知,操作①萃取,②分液,③ 蒸馏,④过滤,⑤蒸发;(2)除去无色液体Ⅰ中的Ca2+、Mg2+、SO42ˉ,需要用过量的BaCl2除去溶液中的SO42ˉ,用过量的KOH除去溶液中的Mg2+,用过量的K2CO3除去溶液中的Ca2+和Ba2+,因此三种试剂的顺序满足条件:BaCl2必须在K2CO3之前,而KOH可前、可后、可中间,故答案:BaCl2、K2CO3、KOH(或KOH、BaCl2、K2CO3或BaCl2、KOH、K2CO3);(3)调节pH的目的是除去溶液中过量的OH-及CO;操作方法是:滴加稀盐酸,无气体产生时,用pH试纸测定至溶液的pH=7 ;(4)蒸发操作中用到的瓷质仪器是蒸发皿。


 全能测控期末小状元系列答案
全能测控期末小状元系列答案科目:高中化学 来源: 题型:
【题目】氨催化氧化法制硝酸的原理为4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
4NO(g)+6H2O(g)。在浓氨水中通入空气,将赤热铂丝插入氨水中引发反应后铂丝保持红热状态至反应停止。下列说法正确的是
A.上述反应在较高温度下才能自发进行
B.该反应的正反应活化能小于逆反应活化能
C.该反应中,断裂化学键的总键能大于形成化学键的总键能
D.若NH3和O2的混合气发生上述反应,气体通入足量水中,剩余气体一定是O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容容器中,2SO2(g) + O2(g)![]() 2SO3 (g) △H=-296.6kJ/mol,下列判断不正确的是
2SO3 (g) △H=-296.6kJ/mol,下列判断不正确的是
A.2体积SO2和足量O2反应,一定不能生成2体积SO3
B.其他条件不变,增大压强,正反应速率增大逆反应速率也增大
C.加入2molSO2和1molO2放出的热量是加入1molSO2和0.5molO2放出热量的2倍
D.平衡后再加入1molSO3,SO2的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:2X(g)+Y(g) ![]() 2Z(g)在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如右图所示,下列判断正确的是( )
2Z(g)在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n(Z)和反应时间t的关系如右图所示,下列判断正确的是( )
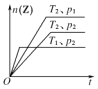
A.T1<T2,p1<p2,正反应为放热反应
B.T1>T2,p1>p2,正反应为吸热反应
C.T1>T2,p1>p2,正反应为放热反应
D.T1>T2,p1<p2,正反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】雾霾中对人伤害最大的是PM2.5,即空气动力学直径小于2.5微米的粒子。分散质粒子直径约为2.5微米的分散系与下列哪种分散系最为接近
A.溶液 B.胶体 C.浊液 D.气溶胶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学-选修3:物质结构和性质】 砷的一些化合物常用作半导体、除草剂、杀鼠药等,回答下列问题:
(1)写出基态砷原子的电子排布式_________________;有_________________个未成对电子。
(2)稼氮砷合金材料的太阳能电池效率达40%。Ga、N、As电负性由大到小的顺序是____________;
(3)As4O6的分子结构如图所示,其中As原子的杂化方式为______________,1mol As4O6含有![]() 键的物质的量为____________mol。
键的物质的量为____________mol。

(4)As与N是同族元素,AsH3的沸点比NH3的沸点 ,原因是 。
(5)H3AsO4和H3AsO3是砷的两种含氧酸,根据结构与性质的关系,H3AsO4的酸性比H3AsO3强的原因是: 。
(6)晶胞有两个基本要素
①原子坐标参数,表示晶胞内部各原子的相对位置,LiZnAs基稀磁半导体的晶胞如图所示,其中原子坐标参数A处Li为(0,0,1/2);B处As为(1/4,1/4,1/4);C处Li的坐标参数为 。
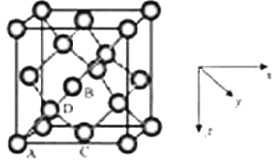
②晶胞参数,描述晶胞的大小和形状,已知LiZnAs单晶的晶胞参数,a=594pm,NA表示阿伏伽德罗常数的数值,其密度为 gcm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物反应类型的说法正确的是
A. 乙烯和乙烷都能发生加成反应
B. 苯只能发生加成反应不能发生取代反应
C. 卤代烃和醇都能发生消去反应
D. 乙醇和乙酸都能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在宇宙飞船和太空站中工作的宇航员,在密闭的工作舱内需要吸入氧气,呼出CO2,飞船内可以使用一种物质,它能吸收CO2,产生氧气,其中主要反应的方程式为_______________。当产生560升氧气(标况)时,反应中转移电子的数目是___________。
(2)在NaOH溶液中ClO2与H2O2反应可以得到亚氯酸钠(NaClO2),ClO2中氯元索的化合价是__________;在制备亚氯酸钠的反应中ClO2做___________(填“氧化剂”或“还原剂”);若反应中生成1molNaClO2;转移电子物质的量为__________mol。
(3)溶液的导电能力大小主要是由离子浓度大小决定的,利用“液体导电性的实验装置”(如图所示)作下列实验,灯泡能出现:亮一暗一熄灭一亮,现象的是__________。
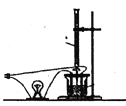
A.向BaCl2溶液中滴入稀H2SO4
B.向Ba(OH)2溶液中滴入稀H2SO4
C.向NaOH溶液中滴入盐酸,写出所选项的离子反应方程式_______________。
(4)己知氯气与热烧碱溶液反应如下:3Cl2+6NaOH=NaClO3+5NaCl+3H2O,
①用双线桥法标出电子转移的方向和数目。
②当有0.1mol电子转移时,参加反应的Cl2在标准状况下的体积_______mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机化合物的说法正确的是
A. 苯和甲苯互为同系物,都能使高锰酸钾褪色
B. 对二甲苯与氢气完全加成的产物的一氯代物有3种
C. 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量不相等
D. 淀粉、油脂、蛋白质的水解产物都是非电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com