
【题目】有机物A-H能发生下图所示一系列变化
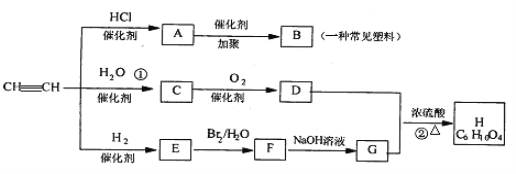
(1)试回答下列:
(1)写出B、G的结构简式:B____________G____________
(2)C 分子中含有的官能团名称是____________,检验该官能团的方法是__________________。
(3)写出化学方程式:
① _________________________________
② _________________________________
【答案】 ![]() CH2OH-CH2OH 醛基 取含该官能团的有机物溶液与银氨溶液水浴共热,试管壁产生光亮的银镜(其他合理回答也给分) CH=CH +H2O
CH2OH-CH2OH 醛基 取含该官能团的有机物溶液与银氨溶液水浴共热,试管壁产生光亮的银镜(其他合理回答也给分) CH=CH +H2O![]() CH3CHO CH2OHCH2OH+2CH3COOH
CH3CHO CH2OHCH2OH+2CH3COOH ![]() CH3COOCH2-CH2OOCCH3 + 2H2O
CH3COOCH2-CH2OOCCH3 + 2H2O
【解析】本题分析:本题主要考查有机物的结构与性质。
(1)A是氯乙烯,B是聚氯乙烯,B的结构简式为![]() ;G是乙二醇,其结构简式为CH2OH-CH2OH 。
;G是乙二醇,其结构简式为CH2OH-CH2OH 。
(2)C 是乙醛,分子中含有的官能团名称是醛基,检验该官能团的方法是:取含该官能团的有机物溶液与银氨溶液水浴共热,试管壁产生光亮的银镜。
(3) ①发生加成反应,生成不稳定物质乙烯醇,乙烯醇异构化为乙醛,化学方程式为CH=CH +H2O![]() CH3CHO
CH3CHO
②乙酸与乙二醇发生酯化反应,化学方程式为CH2OHCH2OH+2CH3COOH ![]() CH3COOCH2-CH2OOCCH3 + 2H2O。
CH3COOCH2-CH2OOCCH3 + 2H2O。


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
【题目】I、将气体A、B置于固定容积为2L的密闭容器中,发生如下反应:
3A(g) +B(g)![]() 2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
2C(g)+2D(g),反应进行到10s末,达到平衡,测得A的物质的量为1.8mol,B的物质的量为0.6mol,C的物质的量为0.8mol,则:
(1)用C表示10s 内正反应的化学反应速率为___________________;
(2)反应前A的物质的量浓度是___________________________;
Ⅱ、某温度下,在一个体积为2L的固定不变的密闭容器中充入0.3mol SO2和0.2mol O2,发生反应2SO2(g)+O2(g)![]() 2SO3(g) 反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为___________。
2SO3(g) 反应。5分钟后反应达到化学平衡状态,测得容器中气体压强变为原来的90% ,则该反应达到平衡时SO2的转化率为___________。
III、已知在容积固定的密闭容器中充入NH3和O2发生如下反应:
4NH3(g)+5O2(g) ![]() 4NO(g)+6H2O(g)
4NO(g)+6H2O(g)
下列能说明该反应已经达到平衡状态的是___________;
A.容器中气体总质量不变 B.c(O2)不变 C.v (O2)=1.25 v(NH3)
D.体系压强不变 E.相同时间内,消耗0.1 mol NH3,同时消耗了0.1 mol NO
Ⅳ、在一定条件下,可实现如图所示物质之间的变化:

(1)已知孔雀石的主要成分是CuCO3·Cu(OH)2(碱式碳酸铜),受热易分解。
则图中的F是____________(填化学式)。
(2)写出明矾[KAl(SO4)2·12H2O] 与过量NaOH溶液反应的离子方程式:
_____________________________________________。
(3)图中所得C和D都为固体,混合后在高温下可发生反应,写出该反应的化学方程式:
________________________________________________。
Ⅴ、海带提碘的流程如下:

(1)第②步为了加快溶解速率并使充分进入溶液中,可以采取的措施是:
______________________、______________________(写出两条)。
(2)写出第④步发生反应的离子方式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯可以通过丁二烯与乙烯发生环化加成反应得到:
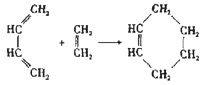 (也可表示为:
(也可表示为: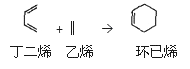 )
)
实验证明,下列反应中反应物分子的环外双键比环内双键更容易被氧化:
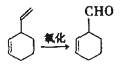
现仅以丁二烯为有机原料,无机试剂任选,按下列途径合成甲基环己烷:
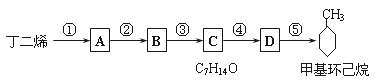
请按要求填空:
(1)A的结构简式是________________;B的结构简式是_______________。
(2)写出下列反应的化学方程式和反应类型:反应④______________,反应类型_____反应;⑤_____________,反应类型_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 摩尔是七个基本物理量之一
B. 1molH2SO4中含有阿伏伽德罗常数个氢原子
C. 1个氧气分子的质量约为32/NA g
D. 硫酸根离子的摩尔质量是96 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某密闭容器中充入等物质的量的A和B,一定温度下发生反应A(g)+xB(g)![]() 2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是

A.30min时降低温度,40min时升高温度
B.反应方程式中的x=1,正反应为吸热反应
C.8min前A的平均反应速率为0.08mol/(Lmin)
D.30min~40min间该反应使用了催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,把一个盛有一定量甲烷和氯气的密闭容器放在光亮的地方,两种气体发生反应,下列叙述不正确的是
A. 容器内原子总数不变 B. 容器内分子总数不变
C. 容器内压强不变 D. 容器内壁出现油状液滴,且气体颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.碳酸钙与盐酸反应:CO32-+H+=H2O+CO2
B.铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2
C.硝酸与氢氧化钡反应:OH-+H+=H2O
D.铜片插入硝酸银溶液中Cu+Ag+=Cu2++Ag
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分为H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
![]()
(1)步骤I,CO变换反应的能量变化如下图所示:

①CO变换反应的热化学方程式是________________。
②一定条件下,向体积固定的密闭容器中充入aL半水煤气,发生CO变换反应。测得不同温度(T1,T2)氢气的体积分数ψ(H2)与时间的关系如下所示。
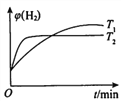
i.T1、T2的大小关系及判断理由是______________。
ii.请在上图中画出:其他条件相同时,起始充入0.5aL半水煤气,T2温度下氢气的体积分数ψ( H2)随时间的变化曲线。______________
(2)步骤Ⅱ,用饱和Na2CO3溶液作吸收剂脱除CO2时,初期无明显现象,后期有固体析出。
①溶液中离子浓度关系正确的是__________(选填字母)。
a.吸收前:c(Na+)>c(CO32-)>c(OH-)>c(HCO3-)
b.吸收初期:2c(CO32-)+2 c(HCO3-)+2c(H2CO3)=c(Na+)
c.吸收全进程:c(Na+)+c( H+)=2c(CO32-)+ c(HCO3-)+ c(OH-)
②后期析出固体的成分及析出固体的原因是___________。
③当吸收剂失效时,请写出一种可使其再生的方法(用化学方程式表示):____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com