
 MnO2是常见的氧化剂、催化剂和活性电极材料.
MnO2是常见的氧化剂、催化剂和活性电极材料.分析 (1)以石墨为电极,电解酸化的MnSO4溶液,阳极锰离子放电,生成二氧化锰,结合电荷守恒和原子守恒书写;
(2)①MnCO3(s)?MnO(s)+CO2(g)△H1 K1
②2MnO(s)+O2(g)?2MnO2(s)△H2 K2
③2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g)△H3 K3
盖斯定律计算①×2+②得到③,平衡常数等于生成物浓度的幂之积比上反应浓度的幂之积,固体不代入表达式;
(3)反应自发进行的判断依据是△H-T△S<0;
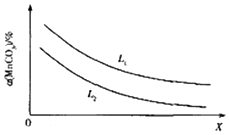
(4)①图象分析可知,反应前后气体体积增大,增大压强平衡逆向进行,碳酸锰分解率减小,则x为压强,L为温度,反应为吸热反应,升温平衡正向进行;
②保持温度不变,将容器体积扩大至原来的2倍,压强减小,平衡正向进行;
③保持温度不变,将容器体积压缩至原来的一半,浓度增大,压强增大平衡逆向进行;
(5)结合化学平衡三行计算列式计算平衡状态下气体浓度,平衡常数K=$\frac{生成物平衡浓度幂次方乘积}{反应物平衡浓度幂次方乘积}$×100%.
解答 解:(l)阳极发生氧化反应,锰由+2价变成+4价,电极反应为Mn2++2H2O-2e-=MnO2+4H+,
故答案为:Mn2++2H2O-2e-=MnO2+4H+;
(2)①MnCO3(s)?MnO(s)+CO2(g)△H1 K1
②2MnO(s)+O2(g)?2MnO2(s)△H2 K2
③2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g)△H3 K3
盖斯定律计算①×2+②得到③,△H3=2△H1+△H2,K3=K12•K2,
故答案为:2△H1+△H2; K12•K2;
(3)2MnO(s)+O2(g)?2MnO2(s),△S<0,反应②在低温条件下能自发进行则△H<0,才能满足△H-T△S<0,
故答案为:<;
(4)①图象分析可知,反应前后气体体积增大,增大压强平衡逆向进行,碳酸锰分解率减小,则x为压强,L为温度,反应为吸热反应,升温平衡正向进行碳酸锰分解率增大,所以L1>L2,
故答案为:>;
②在一定温度下,达到平衡状态时ρ(CO2)=2a MPa.保持温度不变,将容器体积扩大至原来的2倍,浓度减小为原来的一半,压强减小为原来的一半,压强减小平衡正向进行,ρ(CO2)的变化范围是a MPa<ρ(CO2)≤2a MPa,
故答案为:a MPa<ρ(CO2)≤2a MPa;
③保持温度不变,将容器体积压缩至原来的一半,MnCO3(s)?MnO(s)+CO2(g)△H>0.
A.平衡常数只随温度变化,不随压强变化,故A正确;
B.温度不变平衡常数不变,则c(CO2)不变,故B正确;
C.增大压强平衡逆向进行,二氧化碳物质的量n(CO2)减小,故C错误;
D.增大压强平衡逆向进行,m(MnCO3)质量增大,故D错误;
故答案为:AB;
(5)-定温度下,在容积为2L的恒容密闭容器中加人足量的MnCO3(s)和5molO2,发生反应:2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g),CO2以平均速率0.1mol•L-1•min-1经过10min达到平衡状态.生成二氧化碳浓度=0.1mol•L-1•min-1×10min=1mol/L,
2MnCO3(s)+O2(g)?2MnO2(s)+2CO2(g),
起始量(mol/L) 2.5 0
变化量(mol/L) 0.5 1
平衡量(mol/L) 2.0 1
该条件下该反应的平衡常数K=$\frac{{1}^{2}}{2.0}$=0.55mol.L-1 ,
故答案为:0.5mol.L-1.
点评 本题考查了热化学方程式书写、平衡常数计算、影响化学反应速率和化学平衡的因素、图象的理解应用等,掌握基础是解题关键,题目难度中等.


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 往0.3mol/L的NH3•H2O溶液中加入少量NaOH固体,NH3•H2O的电离平衡向逆反应方向移动,同时溶液中c(OH-)•c(NH4+)/c(NH3•H2O)将减小 | |
| B. | PH=9的NaOH溶液和NH3•H2O溶液中,由水电离出的c(H+)前者小于后者 | |
| C. | 浓度均为0.1mol/L的CH3COOH与CH3COONa溶液等体积混合后,PH=5,则混合溶液中:c(CH3COO-)-c(CH3COOH)=2×(10-5-10-9)mol/L | |
| D. | 相同条件下,将足量的氢氧化铁固体加入到相同体积的下列溶液:①蒸馏水②0.1mol/L氢氧化钠③0.1mol/L氢氧化钡④0.1mol/L氯化铁,则铁离子浓度:④>①>②═③ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在蒸发皿中加热胆矾晶体制无水硫酸铜 | |
| B. | 用向下排空气法收集 NO2 气体 | |
| C. | 用 K3[Fe(CN)6]溶液检验 FeCl2 溶液中的 Fe2+ | |
| D. | 将 CO2 与 HCl 混合气体通过碱石灰可得到纯净的 CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y和Z以质量比7:16组成的共价化合物有两种 | |
| B. | X和Y、X和Z组成的常见化合物,稳定性前者大于后者 | |
| C. | X、Z、W简单离子的半径由大到小的顺序为:Z>W>X | |
| D. | X、Y、Z可以组成一种离子化合物,其中X、Y、Z元素原子个数比为4:2:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
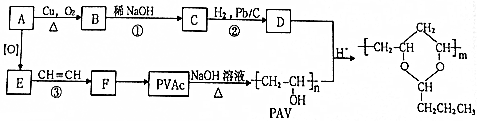

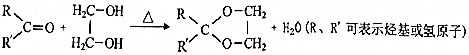
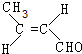 ,该分子中最多有9个原子共平面;
,该分子中最多有9个原子共平面; $→_{△}^{NaOH}$
$→_{△}^{NaOH}$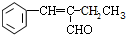 +H2O;
+H2O;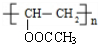 ;
;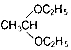 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
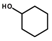 )常用来制取增塑剂和作为工业溶剂.下列说法正确的是( )
)常用来制取增塑剂和作为工业溶剂.下列说法正确的是( )| A. | 环己醇中至少有12个原子共平面 | |
| B. | 与环己醇互为同分异构体,且含有醛基(-CHO)的结构有8种(不含立体结构) | |
| C. | 标准状况下,1mol环己醇与足量Na反应生成22.4LH2 | |
| D. | 环己醇的一氯代物有3种(不含立体结构) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14g由N2与CO组成的混合气体含有的原子数目为NA | |
| B. | 常温常压下,1molNO2气体与水完全反应,转移电子数为NA | |
| C. | 标准状况下,11.2LC2H5OH中所含的分子数为0.5NA | |
| D. | 常温常压下,17gNH3中含有的共用电子对数为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
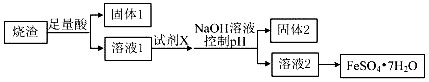
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肾功能衰竭等疾病引起的血液中毒,可利用血液透析进行治疗 | |
| B. | 氯化钙溶液中加入碳酸钠溶液会出现白色沉淀 | |
| C. | 水泥、冶金工厂常用高压电除去工厂烟尘,减少对空气的污染 | |
| D. | 江河入海口形成三角州 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com