
【题目】运用化学链燃烧技术有利于提高燃料利用率。化学链燃烧技术的基本原理是借助载氧剂(如Fe2O3,FeO等)将燃料与空气直接接触的传统燃烧反应分解为几个气固反应,燃料与空气无须接触,由载氧剂将空气中的氧气传递给燃料。回答下列问题:
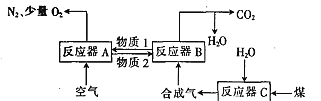
Ⅰ.以Fe2O3作载氧剂的化学链燃烧循环转化反应的部分热化学方程式如下,循环转化的原理如图所示:
①C(s) +H2O(g) = CO(g)+ H2(g) ΔH = akJmol-1
②CO(g)+ H2(g) + O2(g) = CO2(g) +H2O(g) ΔH = bkJmol-1
(1)写出图中总反应的热化学方程式:_____________________________
(2)空气经反应器A后得到的尾气___________(填“能”或“不能”)直接用作工业合成氨的原料气,原因是_____________________。
Ⅱ.用FeO作载氧剂,部分反应的lgKp [K是用平衡分压(平衡分压=总压×物质的量分数)代替平衡浓度]与温度的关系如图所示。
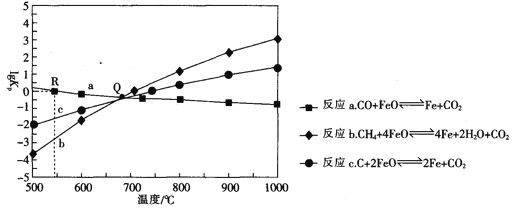
(3)图中涉及的反应中,属于吸热反应的是反应_________________(填字母)。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,只发生反应CO(g)+ FeO(s) ![]() CO2(g) +Fe(s),则CO的平衡转化率为______________.
CO2(g) +Fe(s),则CO的平衡转化率为______________.
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
(5)T℃下,该反应的Kp = _____________________.
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时反应向__________________(填“正反应”或“逆反应”)方向进行。
(7)其他条件不变,若将该容器改为恒压密闭容器,则此时CH4的平衡转化率___________(填“增大”“减小”或“不变”)。
【答案】C(s) O2(g) = CO2(g) ΔH = (a + b)kJmol-1 不能 经反应器A得到的尾气中含有少量氧气,氧气与氢气混合可能发生爆炸 bc 50% P02 正反应 增大
【解析】
Ⅰ(1)应用盖斯定律进行计算。
(2)空气经反应器A后得到的尾气,尾气是氮气和少量氧气的混合物,和氢气接触,氢气和氧气容易发生爆炸。
Ⅱ(3)反应a,升高温度,lgKp减小,Kp减小;反应b、c,升高温度,lgKp增大,Kp增大,再分析每一个反应平衡移动得出结论。
(4)建立“三步走”,再计算压强平衡常数,最后得出结论。
Ⅲ(5)先建立“三步走”,计算消耗的量,再根据压强平衡常数进行计算。
(6)利用压强之比等于物质的量之比,得出此时压强,再根据计算此时的压强常数,与平衡压强常数比较,再得出结论。
(7)利用相当于改变压强的情况来分析平衡怎样移动,得出平衡转化率变化。
Ⅰ(1)应用盖斯定律,第一个方程式加上第二个方程式,得到总反应的热化学方程式:C(s) O2(g) = CO2(g) ΔH = (a + b)kJmol-1,故答案为:C(s) O2(g) = CO2(g) ΔH = (a + b)kJmol-1。
(2)空气经反应器A后得到的尾气,尾气是氮气和少量氧气的混合物,和氢气接触,氢气和氧气容易发生爆炸,因此不能直接用作工业合成氨的原料气,原因是经反应器A得到的尾气中含有少量氧气,氧气与氢气混合可能发生爆炸,故答案为:不能;经反应器A得到的尾气中含有少量氧气,氧气与氢气混合可能发生爆炸。
Ⅱ(3)反应a,升高温度,lgKp减小,Kp减小,平衡逆向移动,逆向是吸热反应,正向为放热反应,反应b、c,升高温度,lgKp增大,Kp增大,平衡正向移动,正向是吸热反应,即属于吸热反应的是反应b、c,故答案为:b、c。
(4)R点对应温度下,向某恒容密闭容器中通入1molCO,并加入足量的FeO,lgKp=0,Kp=1。


解得x = 0.5mol
![]() ,则CO的平衡转化率为50%,故答案为:50%。
,则CO的平衡转化率为50%,故答案为:50%。
Ⅲ.在T℃下,向某恒容密闭容器中加入1molCH4(g)和4mol FeO(s)进行反应:CH4(g) + 4FeO(s) ![]() 4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
4Fe(s) +2H2O(g) +CO2(g)。反应起始时压强为P0,反应进行至10min时达到平衡状态,测得此时容器的气体压强是起始压强的2倍。
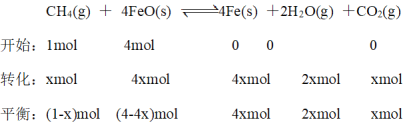
根据压强之比等于物质的量之比,P0:2P0=1mol:(1-x+2x+x)mol,解得x=0.5mol,
(5)T℃下,该反应的 ,故Kp = P02,故答案为:P02。
,故Kp = P02,故答案为:P02。
(6)若起始时向该容器中加入1molCH4(g),4molFeO(s),1mol H2O(g),0.5molCO2(g),此时物质的量是原来的2.5倍,因此压强是原来的2.5倍,此时 ,因此反应向正反应方向进行,故答案为:正反应。
,因此反应向正反应方向进行,故答案为:正反应。
(7)将该容器改为恒压密闭容器,容器体积变大,相当于在原来容器基础上减小压强,平衡正向移动,CH4的平衡转化率增大,故答案为:增大。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】碱式碳酸铜可用于有机催化剂、杀虫剂及饲料中铜的添加剂,还可用于烟火和颜料制造。CuSO4 溶液与Na2CO3 溶液反应能否得到碱式碳酸铜?某班同学进行相关探究。
(沉淀制备)称取 12.5 g 胆矾溶于 87.4 mL 蒸馏水中,滴 4 滴稀硫酸,充分搅拌后得到 CuSO4 溶液。向其中加入适 量 Na2CO3 溶液,将所得蓝绿色悬浊液过滤,用蒸馏水洗涤,再用无水乙醇洗涤。
(1)滴加稀硫酸的作用是______________________。所得硫酸铜溶液的溶质质量分数约 为______________________。
(2)用无水乙醇洗涤的目的是______________________。
(实验探究)同学们设计了如下装置,用制得的蓝绿色固体进行实验:
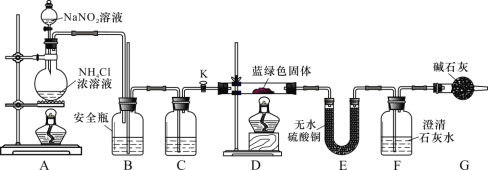
(3)D 装置加热前,需要首先打开活塞 K,用 A 装置制取适量 N2,然后关闭 K,点燃 D 处酒精灯。A 中产生N2 的作用是______________________,C 中盛装的试剂应是______________________。
(4)装置 A 中发生反应的离子方程式为______________________。
(5)若蓝绿色固体的组成为 xCuCO3·yCu(OH)2,实验能观察到的现象是_______________________________________。
(6)同学们查阅文献知:Ksp[CaCO3]=2.8×10-9,Ksp[BaCO3]=5.1×10-9,经讨论认为需要用 Ba(OH)2 代替 Ca(OH)2来定量测定蓝绿色固体的化学式,其原因是 ______________。
a.Ba(OH)2 的碱性比 Ca(OH)2 强
b.Ba(OH)2 溶解度大于 Ca(OH)2,能充分吸收 CO2;
c.相同条件下,CaCO3 的溶解度明显大于 BaCO3
d.吸收等量 CO2 生成的 BaCO3 的质量大于 CaCO3,测量误差小
待 D 中反应完全后,打开活塞 K,再次滴加 NaNO2 溶液产生 N2,其目的是 ________________________________________。若定量分析所取蓝绿色固体质量为 27.1 g,装置 F 中使用 Ba(OH)2 溶液,实验结束后, 装置 E 的质量增加 2.7 g,F 中产生沉淀 19.7 g。则该蓝绿色固体的化学式为 ____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用固体表面催化工艺进行NO分解的过程如下图所示。
![]()
下列说法不正确的是
A.NO属于共价化合物
B.O2含有非极性共价键
C.过程②吸收能量,过程③释放能量
D.标准状况下,NO分解生成11.2LN2转移电子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:AgSCN(白色,s)![]() Ag+(aq)+SCN-(aq),T℃时,Ksp(AgSCN)=1.0×10-12。在T℃时,向体积为20.00mL、浓度为mmol/L的AgNO3溶液中滴加0.l0mol/LKSCN溶液,溶液pAg的与加入的KSCN溶液体积的关系如图所示,下列说法错误的是( )
Ag+(aq)+SCN-(aq),T℃时,Ksp(AgSCN)=1.0×10-12。在T℃时,向体积为20.00mL、浓度为mmol/L的AgNO3溶液中滴加0.l0mol/LKSCN溶液,溶液pAg的与加入的KSCN溶液体积的关系如图所示,下列说法错误的是( )
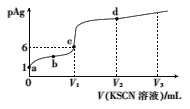
A.m=0.1
B.c点对应的KSCN溶液的体积为20.00mL
C.a、b、c、d点对应的溶液中水的电离程度:a>b>c>d
D.若V3=60mL,则反应后溶液的pAg=11-lg2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,向20mL 0.1 mol/L的CH3COOH溶液中逐滴滴加0.1 mol/L的NaOH溶液,滴入NaOH溶液的体积与溶液pH的变化如图所示。下列说法正确的是
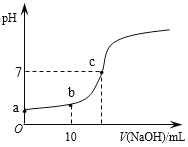
A. a点的pH=1
B. b点时,c (CH3COO—)=0.05mol/L
C. c点时,V(NaOH)=20mL
D. 反应过程中![]() 的值不断增大
的值不断增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯氧布洛芬具有良好的解热、镇痛、抗炎、抗风湿作用,苯氧布洛芬的合成路线如下:
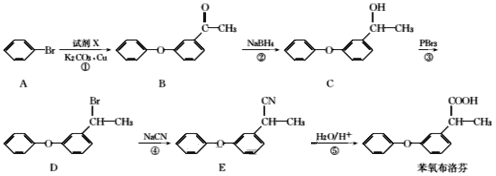
回答下列问题:
(1)苯氧布洛芬中官能团的名称为___。
(2)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。A-D四种物质中,含有手性碳的有机物为___(填字母)。
(3)反应②的反应类型是___。
(4)若过程①发生的是取代反应,且另一种产物为HBr,由A生成B发生反应的化学方程式为___。
(5)有机物M与C互为同分异构体,M满足下列条件:
I.能与FeCl3溶液发生显色反应,1molM可消耗2molNaOH;
Ⅱ.M分子中有6种不同化学环境的氢,核磁共振氢谱为3:2:2:2:2:3,且分子中含有![]() 结构。
结构。
M的结构有___种,写出其中一种结构简式:___。
(6)根据已有知识并结合相关信息,写出以丙酮(CH3COCH3)为原料制备2一甲基丙酸的合成路线流程图(无机试剂任用)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.将Na2O2投入NH4Cl溶液中只可能生成一种气体
B.铁分别与稀盐酸和硫反应,产物中铁元素的化合价相同
C.向饱和ZnS溶液中加入Na2S有沉淀析出,但KSP(ZnS)不变
D.在滴有酚酞的Na2CO3溶液中,加入适量BaCl2溶液后溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三室式电渗析法处理含Na2SO4废水的原理如图所示,采用惰性电极,ab、cd均为离子交换膜,在直流电场的作用下,两膜中间的Na+和SO42-可通过离子交换膜,而两端隔室中离子被阻挡不能进入中间隔室。下列叙述正确的是( )

A. 通电后中间隔室的SO42-离子向正极迁移,正极区溶液碱性增强
B. 该法在处理含Na2SO4废水时可以得到NaOH和H2SO4产品
C. 阴极区溶液pH降低,阳极区溶液pH升高
D. 当电路中通过1mol电子的电量时,会有0.5mol的O2生成
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com