
【题目】溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物貭的量之向的关系如图所示。则下列説法正确的是( )

A. 溶液中的阳离子一定含有H+、Mg2+、Al3+,可能含有Fe3+
B. 溶液中一定不含CO32-和NO3-,一定含有SO42-
C. 溶液中C(NH4+)=0.2mol/L
D. c(H+):c(Al3+):c(Mg2+)=l:1:1
【答案】B
【解析】
本题考查离子共存,反应图像识别以及离子反应有关计算等,有利于培养学生的逻辑思维能力和发散思维能力,注意把握图像中各个阶段发生的反应。
加入氢氧化钠溶液,产生白色沉淀,说明不存在铁离子,根据产生的沉淀量与加入氢氧化钠的物质的量之间的关系图可知,溶液中一定有镁离子和铝离子,又因为当沉淀达到最大值时,继续加入氢氧化钠,沉淀不变,这说明溶液还存在铵根离子,由于溶液中还必须存在阴离子,所以一定还有硫酸根离子。由图像可知,第一阶段为氢离子和氢氧化钠反应,消耗氢氧化钠为0.1mol,则氢离子物质的量为0.1mol,第三阶段为铵根离子与氢氧化钠反应,消耗氢氧化钠为0.7-0.5=0.2mol,则铵根离子物质的量为0.2mol,最后阶段为氢氧化钠溶解氢氧化铝,消耗氢氧化钠0.8-0.7=0.1mol,则氢氧化铝的物质的量为0.1mol,,根据铝元素守恒可知铝离子的物质的量为0.1mol,第二阶段为氢氧化钠沉淀镁离子、铝离子,共消耗氢氧化钠为0.5-0.1=0.4mol,则镁离子物质的量为(0.4-0.1×3)÷2=0.05mol。A. 由上述分析,溶液中的阳离子一定只有氢离子、镁离子、铝离子、铵根离子,故错误;B. 由上述分析,溶液中有镁离子和铝离子和氢离子,所以一定不含碳酸根离子,因为和锌反应生成氢气,所以不含硝酸根离子,根据电荷守恒,溶液中一定含有硫酸根离子,故正确;C. 根据以上分析,铵根离子的物质的量为0.2mol,因为没有溶液的体积,不能计算其物质的量浓度,故错误;D.根据计算, c(H+):c(Al3+):c(Mg2+)=0.1:0.1:0.05=2:2:1,故错误。故选B。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】五种短周期元素a、b、c、d、e,其原子半径与原子序数的关系如图,下列说法错误的是
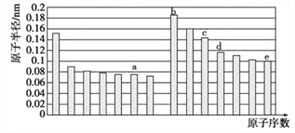
A. c元素的离子半径比e的离子半径小
B. d元素对应的最高价氧化物的水化物酸性比e元素弱
C. b、c、d三种元素对应的最高价氧化物的水化物相互间能发生反应
D. a与b两种元素可形成既有离子键又有非极性共价键的化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作不是从安全角度考虑的是
A.用氯酸钾和二氧化锰制氧气时用排水法收集后,应从水中撤出导管后再停止加热
B.酒精灯在不使用时,必须盖上灯帽
C.实验室制备CO气体必须在通风橱中进行
D.蒸馏操作时应在混合液中加入沸石
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对利用甲烷消除NO2污染进行研究,CH4+2NO2![]() N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
N2+CO2+2H2O。在1L密闭容器中,控制不同温度,分别加入0.50molCH4和1.2molNO2,测得n(CH4)随时间变化的有关实验数据见下表。
组别 | 温度 | 时间/min n/mol | 0 | 10 | 20 | 40 | 50 |
① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | 0.15 |
下列说法正确的是( )
A. 由实验数据可知实验控制的温度T2>T1
B. 组别①中,0~20min内,NO2的降解速率为0.0125mol·L-1·min-1
C. 40min时,表格中T2对应的数据为0.18
D. 0~10min内,CH4的降解速率①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池已经成为应用最广泛的可充电电池。某种锂离子电池的结构示意图如下图所示,其中两极区间的隔膜只允许Li+通过。电池放电时的总反应方程式为:
Li1-xCoO2+xLi==LiCoO2。关于该电池的推论错误的是

A. 放电时,Li+主要从负极区通过隔膜移向正板区
B. 放电时,负极反应为:xLi-xe-=xLi+
C. 电解貭溶液不能是水溶液
D. 充电时,负极(C)上锂元素被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于原电池的说法错误的是( )
A.原电池是将化学能转化为电能的装置
B.原电池负极发生氧化反应
C.原电池中,阳离子向负极移动
D.原电池电子流出的一极为负极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,向100 mL含氯化氢14.6 g的盐酸溶液里放入5.60 g纯铁粉(不考虑反应前后溶液体积的变化),反应开始至2 min末,收集到1.12 L(标准状况)氢气。在此之后,又经过4 min,铁粉完全溶解。则:
(1)在前2 min内用FeCl2表示的平均反应速率是。
(2)在后4 min内用HCl表示的平均反应速率是。
(3)前2 min与后4 min相比,反应速率较快的是。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌元素对婴儿及青少年的智力和身体发育有重要的作用,被称为生命火花。利用恒电势电解NaBr溶液间接将葡萄糖[CH2OH(CHOH)4CHO]氧化为葡萄糖酸[CH2OH(CHOH)4COOH],进而制取葡萄糖酸锌,装置如图所示,下列说法错误的是

A. 钛网与直流电源的正极相连
B. 石墨电极的反应为:2H2O+2e-=H2↑+2OH-
C. 电解过程中硫酸钠溶液浓度保持不变
D. .生成葡萄糖酸的方程式为:CH2OH(CHOH)4CHO+Br2+H2O=CH2OH(CHOH)4COOH+2HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种原子:①![]() ②
②![]() ③
③![]() ④
④![]()
(1)其中能与②形成离子键的是___________(填序号)。
(2)①的核外电子数是____;①和②形成的化学键是_____(填“极性键”或“非极性键”)。
(3)②和③互为同位素的本质原因是___________。
(4)④的原子结构示图是______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com