
下列说法正确的是
A.氨的催化氧化是一种特殊的固氮方式
B.工业冶炼铝:电解熔融AlCl3固体
C.将铁粉加入FeCl3、CuCl2混合溶液中,充分反应后剩余的固体中不一定有铁
D.用加热分解的方法可将NH4Cl固体和Ca(OH)2固体的混合物分离
 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
下列说法中正确的是
A.CH3CH2OH、SO3和水分别属于非电解质、强电解质和弱电解质
B.为测定熔融氢氧化钠的导电性,可将氢氧化钠固体放在石英坩埚中加热熔化
C.煤油可由石油分馏获得,可用于保存少量金属钠
D.工业上金属Mg、Al都是用电解其相应的氯化物水溶液制得的
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:选择题
下列离子方程式中正确的是( )
A.往CaCl2溶液中通入少量的CO2: Ca2++ CO2+ H2O === CaCO3↓+ 2H+
B.向碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+ OH-=== CO32-+ H2O
C.向AlCl3溶液中加入过量的浓氨水:Al3+ + 4NH3·H2O === A1O2- + 4NH4+ + 2H2O
D.钠与水的反应:2Na + 2H2O === 2Na+ + 2OH- + H2↑
查看答案和解析>>
科目:高中化学 来源:2015届广东省东莞市高三第一次调研考试理科化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数,下列叙述正确的是(Fe 56)
A.1mol?L-1 NaHCO3溶液中的Na+数为NA
B.常温时,2.24LCO2所含的氧原子数为0.2NA
C.5.6g Fe与足量稀盐酸反应,转移电子数为0.2NA
D.标准状况下,2.24L CCl4所含分子数为0.1NA
查看答案和解析>>
科目:高中化学 来源:2015届广东省七校高三上学期第一次联考理综化学试卷(解析版) 题型:填空题
(16分)氢是一种理想的绿色清洁能源,氢气的制取与储存是氢能源利用领域的研究热点。 利用FeO/Fe3O4循环制氢,已知:
H2O(g)+3FeO(s) Fe3O4(s) + H2(g) △H=a KJ/mol (Ⅰ)
Fe3O4(s) + H2(g) △H=a KJ/mol (Ⅰ)
2Fe3O4(s)=6FeO(s) + O2(g) △H=b KJ/mol (Ⅱ)
下列坐标图分别表示FeO的转化率(图1)和一定温度时,H2生成速率[细颗粒(直径0.25 mm),粗颗粒(直径3 mm)](图2)。
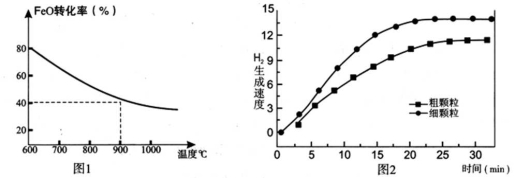
(1)反应:2H2O(g)=2H2(g) + O2(g) ΔH= (用含a、b代数式表示);
(2)在上述循环制氢的过程中FeO的作用是: ;
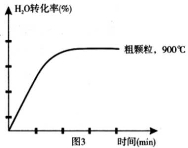
(3)900°C时,在两个体积均为2L密闭容器中分别投入0.60molFeO和0.20mol H2O(g),甲容器用细颗粒FeO,乙容器用粗颗粒FeO。
①用细颗粒FeO和粗颗粒FeO时,H2生成速率不同的原因是: ;
②用细颗粒FeO时,H2O (g)的转化率比用粗颗粒FeO时H2O(g)的转化率 (填“大”或“小”或“相等”);
③求此温度下该反应的平衡常数K(写出计算过程)。
(4)在坐标图3中画出在1000°C、用细颗粒FeO时,H2O(g)转化率随时间变化示意图(进行相应的标注):
查看答案和解析>>
科目:高中化学 来源:2015届山西省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)在Na+浓度为0.9mol/L的某澄清溶液中,还可能含有下表中的若干种离子:
阳离子 | K+、Ag+、Mg2+、Ba2+ |
阴离子 | NO3-、CO32-、SiO32-、SO42- |
取该溶液100mL进行如下实验(气体体积在标准状况下测定):
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀HCl | 产生白色沉淀并放出1.12L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为3.6g |
Ⅲ | 在Ⅱ的滤液中滴加BaC12溶液 | 无明显现象 |
试回答下列问题:
(1)实验I能确定一定不存在的离子是 。
(2)实验I中生成沉淀的离子方程式为 。
(3)通过实验I、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)
阴离子 | NO3- | CO32- | SiO32- | SO42- |
c/mol·L-1 |
|
|
|
|
(4)判断K+是否存在,若存在求其最小浓度,若不存在说明理由 。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:填空题
(10分)某同学探究二氧化硫与BaCl2溶液、Ba(OH)2溶液反应的实验。
(1)少量SO2通入到Ba(OH)2溶液中的离子反应方程式为_____________________________,过量的SO2通入到Ba(OH)2溶液中的离子反应方程式为______________________________。
(2)此同学将SO2通入到BaCl2溶液中,出现了异常现象,看到了明显的白色沉淀,为探究该白色沉淀的成分,他设计了如下实验流程:
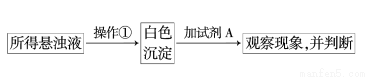
则操作①的名称为____________,试剂A的化学式为____________.
(3)实验表明,此同学加入试剂A后,白色沉淀未见溶解,则该白色沉淀的成分是____________(填化学式),则产生该白色沉淀的离子方程式是_____________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届山东省邹城市高三10月月考化学试卷(解析版) 题型:选择题
下列说法正确的是
A.酸式盐的水溶液一定显酸性
B.酸性氧化物一定是非金属氧化物
C.丁达尔效应是溶液和胶体的本质区别
D.HClO是弱酸,但NaClO是强电解质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com