
【题目】纯的叠氮酸(HN3)是一种弱酸,常温下向25mL 0.1 mol/L NaOH溶液中加入0.2 mol/L HN3溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如下图。下列说法正确的是( )
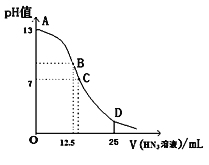
A. 该滴定过程中应用甲基橙作指示剂
B. 若B点pH=8,则c(HN3)=(10-6~10-8 )mol/L
C. 点D对应溶液中存在关系:c(HN3)>c(Na+)>c(N3-)
D. 沿曲线A→B→C的过程中,由水电离产生的c(OH-)逐渐减少
【答案】B
【解析】
A.HN3是一元弱酸,与NaOH等物质的量反应得到的盐是强碱弱酸盐,溶液显碱性,所以滴定时要选择在碱性条件下变色的指示剂酚酞,不能使用酸性范围变色的指示剂甲基橙,A错误;
B.在B点时NaOH与HN3恰好发生中和反应产生NaN3,根据电荷守恒可得c(Na+)+c(H+)=c(OH-)+c(N3-),由于NaOH、HN3的体积已知,所以c(Na+)=(25mL× 0.1 mol/L)÷(25+12.5)mL=0.067mol/L,此时溶液的pH=8,c(H+)=10-8mol/L,c(OH-)=10-6mol/L,可得c(N3-)=c(Na+)+c(H+)-c(OH-)= c(Na+)+10-8-10-6,再根据物料守恒可得c(HN3)+ c(N3-)=c(Na+),所以c(HN3)=(10-6~10-8 )mol/L,B正确;
C. D点时HN3的物质的量是NaOH的2倍,溶液为NaN3、HN3等物质的量关系混合,此时溶液中存在HN3的电离作用和N3-的水解作用,根据图示可知此时溶液显酸性,说明HN3的电离作用大于N3-的水解作用,所以c(N3-)>c(Na+),HN3由于电离而消耗,因此c(Na+)>c(HN3),因此溶液中微粒浓度关系为c(N3-)>c(Na+)>c(HN3),C正确;
D.在A点溶液为NaOH溶液,NaOH是碱,抑制水的电离,随着HN3的加入,溶液的碱性逐渐减弱,水电离程度逐渐增大,当到B点时酸碱恰好中和,水电离程度达到最大值,后再向溶液中加入HN3,这时随着酸的加入,溶液逐渐变为酸性,酸对水的电离起抑制作用,水电离程度由逐渐减小,因此沿曲线A→B→C的过程中,由水电离产生的c(OH-)先逐渐增大到B点时最大,后又逐渐减少,D错误;
故合理选项是B。


科目:高中化学 来源: 题型:
【题目】某温度下,在一个2 L的密闭容器中,加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)![]() 4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的
4C(s)+2D(g),反应一段时间后达到平衡,测得生成1.6 mol C,下列说法正确的
A. 该反应的化学平衡常数表达式是![]()
B. 此时B的平衡转化率是40%
C. 增大该体系的压强,平衡向右移动,化学平衡常数增大
D. 增加B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高纯MnCO3在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:

(1)浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是_________________,植物粉的作用是_________________。
(2)除杂过程的操作为:
①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是____________________________;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式___________。
(3)在30℃~35℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在 6.5~7.0,得到MnCO3沉淀。温度控制35℃以下的原因是_____________;该反应的化学方程式为________;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是__________________________________。
(4)已知:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO3)=2.6×10-5,当离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中所含原子数相同的是( )
A. 10gH2和10gO2B. 5.6LN2(标准状况)和11gCO2
C. 9gH2O和0.75molBr2D. 224mLH2(标准状况)和0.1molN2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标况下,a克气体X与b克气体Y的分子数相同,下列说法错误的是( )
A.X和Y的式量之比是a:b
B.气体X和气体Y的密度比为b:a
C.1g气体X和1g气体Y的分子数之比是a:b
D.1mol气体X和1mol气体Y的质量比是a:b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三蝶烯是最初的“分子马达”的关键组件,三碟烯某衍生物X可用于制备吸附材料,其结构如图所示,3个苯环在空间上互为120°夹角。下列有关X的说法错误的是

A. 分子式为C22H14O4
B. 能发生加成、取代反应
C. 苯环上的一氯代物有3种
D. 分子中最多可能有20个原子位于同一平面上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上以12C作为确定原子量的标准。若把12C的原子量定为24,并规定把24g12C所含碳原子数定为阿伏伽德罗常数,用NA表示,则下列推论中正确的是( )
A.12g碳单质完全燃烧需要体积约为11.2L(标准状况)的氧气
B.44gCO2和28gCO含有相同数目的分子
C.NA个氧分子和1mol氢分子的质量之比为8:1
D.氧气的摩尔质量为64g/mol,所以32g氧气所含分子数目为3.01×1025个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铁矿石(Fe2O3)为起始物,经过一系列反应可以得到Fe3[Fe(CN)6]2和Fe(SCN)3,请回答下列问题:
(1)写出Fe的原子结构示意图_____________________,O原子核外电子轨道表示式为______。
(2)KSCN是检验Fe3+的试剂之一,与SCN-互为等电子体的一种分子为__________。如图是SCN与Fe3+形成的一种配离子,画出该配离子中的配位键(以箭头表示)_______。
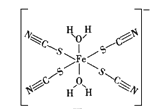
(3)K3[Fe(CN)6]晶体中Fe3+与CN之间的键型为__________,该化学键能够形成的原因是_______。
(4)K3[Fe(CN)5NO]的组成元素中,属于第二周期的元素的第一电离能由小到大的顺序是_____,配合物中原子序数最小的元素与氢元素形成的相对分子质量为92的芳香化合物中,中心原子的杂化轨道类型是_________。
(5)把氯气通入黄血盐(K4[Fe(CN)6])溶液中,得到赤血盐(K3[Fe(CN)6]),写出该变化的化学方程式______。
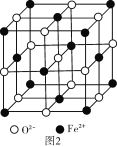
(6)FeO晶胞结构如图2所示,FeO晶体中Fe2+配位数为____,若该晶胞边长为acm,则该晶体密度为___g/cm3(阿伏伽德罗常数的值为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com