
| | 熔点/K | 沸点/K | 标准状况时在水中的溶解度 |
| H2S | 187 | 202 | 2.6 |
| H2O2 | 272 | 423 | 以任意比互溶 |


 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案 周周清检测系列答案
周周清检测系列答案 轻巧夺冠周测月考直通高考系列答案
轻巧夺冠周测月考直通高考系列答案科目:高中化学 来源:不详 题型:单选题
| A.分子中共价键键角均为109°28′ | B.黄砷中共价键键能大于白磷 |
| C.黄砷分子极性大于白磷 | D.黄砷的熔点高于白磷 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.NO2、SO2、BF3分子中所有原子的最外层电子都满足了8e-稳定结构 |
| B.P4和CH4都是正四面体分子且键角都为109o28ˊ |
| C.NaCl晶体中与每个Na+距离相等且最近的Na+共有12个 |
| D.原子间通过共价键而形成的晶体一定具有高的熔、沸点及硬度 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.OCS、CO、CO2、S四种物质的晶体类型相同 |
| B.OCS高温分解时,碳元素化合价升高 |
| C.OCS分子中含有1个σ键和1个π键 |
| D.22.4 L OCS中约含有3×6.02×1023个原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H2S2O7 | B.H2S3O10 | C.H4S3O12 | D.H2S4O13 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.非金属原子间以共价键结合的物质一定是共价化合物 |
| B.含有共价键的化合物一定是共价化合物 |
| C.凡是能电离出离子的化合物一定是离子化合物 |
| D.凡是含有离子键的化合物一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1 mol硫化羰在氧气中完全燃烧时转移6mol电子 |
| B.硫化羰可用作灭火剂 |
| C.CO2和COS结构相似都是非极性分子 |
| D.硫化羰熔点可能较高 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | Al | B | Be | C | Cl | F | Li |
| X的数值 | 1.5 | 2.0 | 1.5 | 2.5 | 2.8 | 4.0 | 1.0 |
| 元素 | Mg | Na | O | P | S | Si | N |
| X的数值 | | 0.9 | 3.5 | 2.1 | 2.5 | 1.7 | |
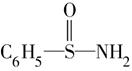 ,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。
,在S—N键,你认为该共用电子对偏向于________原子(填元素符号)。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com