
| A. | abdi | B. | cefk | C. | fghl | D. | bcegj |
 寒假乐园北京教育出版社系列答案
寒假乐园北京教育出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | $\frac{3}{(m-n)}$mL | B. | $\frac{(m-n)}{3}$ mL | C. | $\frac{(4m-1)}{13}$ mL | D. | $\frac{(m-n)}{3}$3 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X中可能有两个羧基和一个羟基 | |
| B. | X中可能有三个羟基和一个 一COOR官能团 | |
| C. | X中肯定有碳碳双键 | |
| D. | X中可能有三个羧基 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1molNaHSO4晶体中阳离子与阴离子总数为0.3NA | |
| B. | 1.0L0.1mol•L-1NH4NO3溶液中含有的铵根离子数是0.1×6.02×1023 | |
| C. | 7.8gNa2O2与足量CO2反应,转移的电子数为0.1NA | |
| D. | 向仅含0.2molFeI2的溶液中持续通入氯气,当有0.1molFe2+被氧化时,需通入标况下C121.12L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ | B. | NO3- | C. | AlO2- | D. | HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
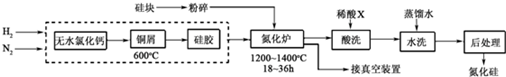
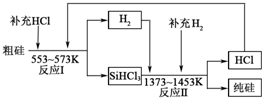
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1×105Pa | 5×105Pa | 10×105Pa | 50×105Pa | 100×105Pa | |
| 450℃ | 97.5 | 98.9 | 99.2 | 99.6 | 99.7 |
| 500℃ | 85.6 | 92.9 | 94.9 | 97.7 | 98.3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与盐酸反应 CO32-+2H+═CO2↑+H2O | |
| B. | 往CuCl2溶液中加入钠 2Na+Cu2+═2Na++Cu | |
| C. | 铁与稀硫酸反应 Fe+2H+═Fe2++H2↑ | |
| D. | 稀硫酸与氢氧化钡溶液反应 H++SO42-+Ba2++OH-═H2O+BaSO4↓ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com