
| 942-247 |
| 2 |
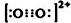 ,故答案为:1:1;
,故答案为:1:1;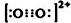 ;
; ,故答案为:三角锥形;
,故答案为:三角锥形; ;
; 

科目:高中化学 来源: 题型:
| A、某有机物燃烧只生成CO2和H2O,且二者物质的量相等,则此有机物的C:H=1:2 |
| B、一种烃在足量的氧气中完全燃烧后的产物通过碱石灰,减少的体积就是生成的二氧化碳的体积(温度>100℃) |
| C、某气态烃CxHy与足量O2完全反应,如果反应前后气体体积不变(温度<100℃),则y=4;若体积减少,则y<4;否则y>4 |
| D、相同质量的烃,完全燃烧,消耗O2越多,烃分子中C、H原子个数比越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、相同温度下,在水中的溶解度:Na2CO3<NaHCO3 |
| B、热稳定性:Na2CO3>NaHCO3 |
| C、都能与足量盐酸反应放出CO2,但产生气体的物质的量不相同 |
| D、与相同浓度的盐酸反应放出CO2的速率Na2CO3大于NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、采用焚烧或深埋的方法处理垃圾 |
| B、推广使用太阳能、风能等新能源 |
| C、提高煤和石油的产量以满足社会对能源的需求 |
| D、将未经处理的工业废水直接排入江河湖泊 |
查看答案和解析>>
科目:高中化学 来源: 题型:
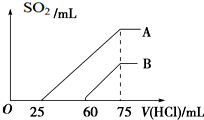 向浓度相等、体积均为50mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100mL.
向浓度相等、体积均为50mL的A、B两份KOH溶液中,分别通入一定量的SO2气体后,再稀释到100mL.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2 min末时A和B的浓度之比为5:3 |
| B、x=2 |
| C、2 min末时B的浓度为1.5 mol?L-1 |
| D、2 min末时A的消耗浓度为0.5 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.1g | B、4.2g |
| C、3.6g | D、不能确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| NaOH(aq) |
| △ |
| CO2 |
| O2/点燃 |
| H2O |
| NH3CO3 |
| △ |
| 石灰乳 |
| 燃烧 |
| Fe |
| Fe |
| A、①③④⑤ | B、②③④ |
| C、①②④ | D、①②③④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com