
【题目】在两份相同的Ba(OH)2溶液中,分别滴入物质的量浓度相等的H2SO4、NaHSO4溶液,其导电能力随滴入溶液体积变化的曲线如下图所示。下列分析不正确的是
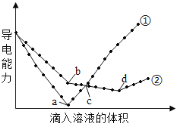
A.①代表滴加H2SO4溶液的变化曲线
B.b点,溶液中大量存在的离子是Na+、OH-
C.a、d两点对应的溶液均显中性
D.c点,两溶液中含有相同物质的量的OH-
【答案】D
【解析】
分析特殊点,a点为硫酸和氢氧化钡恰好反应的点,导电性几乎为零,b点为氢氧化钡和硫酸氢钠反应时钡离子恰好沉淀的点,d点为氢氧化钡和硫酸氢钠反应时恰好中和的点。
A. 根据图知,曲线①在a点溶液导电能力接近0,说明该点溶液离子浓度最小,应该为![]() 溶液和硫酸的反应,则曲线②为
溶液和硫酸的反应,则曲线②为![]() 溶液和硫酸氢钠溶液的反应,故A正确;
溶液和硫酸氢钠溶液的反应,故A正确;
B.根据图知,a点为![]() 溶液和硫酸恰好反应,硫酸和硫酸氢钠溶液的物质的量浓度相等,则b点为钡离子恰好沉淀,溶质为氢氧化钠,B正确;
溶液和硫酸恰好反应,硫酸和硫酸氢钠溶液的物质的量浓度相等,则b点为钡离子恰好沉淀,溶质为氢氧化钠,B正确;
C. a点为![]() 溶液和硫酸恰好反应,显中性,d点为氢氧化钡和硫酸氢钠反应时恰好中和的点,溶液显中性,C正确;
溶液和硫酸恰好反应,显中性,d点为氢氧化钡和硫酸氢钠反应时恰好中和的点,溶液显中性,C正确;
D.c点加入硫酸和硫酸氢钠的物质的量相等,故加入氢离子的量不相等,故氢氧根的量不相等,D错误;
答案选D。


 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。

(1)a、b、c三种元素的原子半径由大到小的顺序是___(填元素符号);b、f、h三种元素对应简单氢化物的热稳定性由强到弱的顺序是___(填化学式)。
(2)c、d、e三种元素最高价氧化物对应水化物中碱性最强的是___(填水化物的化学式)。
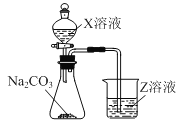
(3)利用如图装置可比较a、e、h的非金属性强弱,则装置中试剂X、Z分别为___(填化学式)。
(4)元素i的原子结构示意图为___;写出元素i的最高价氧化物对应水化物溶液与元素d的单质反应的离子方程式___。
(5)推测原子序数为34的元素在周期表中的位置___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛因具有强度高、耐蚀性好、耐热性高等特点而被广泛用于各个领域。
(1)基态 Ti 原子核外电子排布的最高能级符号是____。与钛同周期的元素中基态原子未成对电子数与钛相同的有__________种。
(2)钛比钢轻,比铝硬,是一种新兴的结构材料。钛硬度比铝大的原因是_____。
(3)半夹心结构催化剂 M 其结构如图所示:
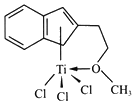
①组成该物的质元素中,电负性最大的是___________(填元素符号)
②M中不含_________(填标号)
a.π键 b.σ键 c.配位键 d.离子键 e.氢键
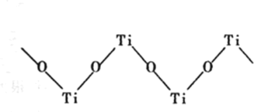
(4)TiO2能溶于浓硫酸并析出一种离子晶体,已知其中阳离子是以链状聚合物形式存在的钛酰阳离子,其结构如图所示,其化学式是______ 写出一种与阴离子![]() 互为等电子体的分子______ 。
互为等电子体的分子______ 。
(5)钛单质的晶胞如图所示,该晶胞为______堆积(填堆积方式),钛原子的配位数是_______,巳知晶胞参数:a=0.295nm,c=0.469nm。则该钛晶体的密度为___________g·cm-3(NA表示阿伏加德罗常数的数值,列出计算式即可)
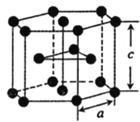
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铼(Re)是种银白色的重金属,是地球地壳中最稀有的元素之一,它广泛应用于航空航天领域。在工业上,高温灼烧含ReS2的矿粉,可以制备Re2O7。另一种途径是从炼铜的废液中提取铼,其简易工艺流程如图(部分副产物省略,铼在废液中以ReO4-形式存在)。下列说法错误的是( )
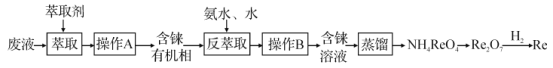
A.在“反萃取”中,加入氨水、水的目的是萃取有机层中的ReO4-
B.在NH4ReO4制备Re2O7的过程中,产生的副产物可回收利用
C.实验室在H2还原Re2O7的过程中,一共消耗7 mol H2,则可制得2 mol Re
D.以含ReS2的矿石原料生产48.4 t Re2O7,理论上转移电子3.0×106 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化铝( AlN)广泛应用于电子、陶瓷工业等领域。在一定条件下,AlN可通过如下反应制取:Al2O3+N2+3C![]() 2AlN+3CO。下列叙述正确的是( )
2AlN+3CO。下列叙述正确的是( )
A.AlN中氮的化合价为+3
B.AlN的摩尔质量为41 g
C.上述反应中,N2是氧化剂,Al2O3既不是氧化剂也不是还原剂。
D.上述反应中,每生成1 mol AlN需转移6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丙烯酸甲酯(CH2=CH—COOCH3)是一种重要的有机合成中间体,沸点为80.5℃。某实验小组制取丙烯酸甲酯的装置如图所示:

回答下列问题:
I.丙烯酸甲酯的制备与提纯
步骤1:将10.0g丙烯酸、6.0g甲醇和2mL浓硫酸放置于三颈烧瓶中,连接好冷凝管,用搅拌棒搅拌,水浴加热。
步骤2:充分反应后,冷却,向混合液中加入5%Na2CO3溶液洗至中性,分离出有机相。
步骤3:有机相经无水Na2SO4干燥、过滤、蒸馏,得丙烯酸甲酯。
(1)步骤1装置如图1所示(加热和夹持装置已略去)。三颈烧瓶中进行的可逆反应化学方程式为___,本实验中最容易产生的副产物的结构简式为___。
(2)仪器b的作用为___。
(3)混合液用5%Na2CO3溶液洗涤的目的是___。
(4)实验室配制100g5%Na2CO3溶液需用到的玻璃仪器是___。
(5)关于产品的蒸馏操作(夹持装置未画出)如图2所示。将步骤3(蒸馏)的操作补齐:安装蒸馏装置,加入待蒸馏的物质和沸石,___,弃去前馏分,收集80.5℃的馏分。
II.丙烯酸甲酯含量的测定
步骤1:将油状物质提纯后平均分成5份,取出1份置于锥形瓶中,加入2.5mol·L-1的KOH溶液10.00mL,加热使之完全水解。
步骤2:用酚酞作指示剂,向冷却后的溶液中滴加0.5mol·L-1的HCl溶液,中和过量的KOH,滴到终点时共消耗盐酸20.00mL。
(6)本次酯化反应丙烯酸的转化率为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:
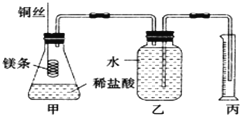
该实验的主要操作步骤如下:
①用已知浓度的浓盐酸配制100mL 1.0mol/L的盐酸溶液,需要用到的仪器有量筒、烧杯、玻璃棒、胶头滴管、______;
②用10mL量筒量取8.0mL 1.0mol/L的盐酸溶液加入锥形瓶中;
③准确称取a g已除去表面氧化膜的镁条,并系于铜丝末端,为使HCl全部参加反应,a的数值至少为______;
④往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;
⑤反应结束后待体系温度恢复到室温,忽略导管中的水,读出量筒中水的体积为VmL。
请回答下列问题。
(1)步骤①中,配制100mL 1.0mol/L的盐酸溶液时,下列哪些操作会使配制浓度偏低_____(填写字母)
A. 用量筒量取浓盐酸时,俯视量筒的刻度
B. 容量瓶未干燥即用来配制溶液
C. 未洗涤烧杯和玻璃棒
D.定容完成后,将容量瓶倒置摇匀后,发现液面低于刻度线
E.在容量瓶中定容时俯视容量瓶刻度线
(2)请填写操作步骤中的空格:步骤①__________ 步骤③__________
(3)实验步骤⑤中应选用________的量筒(填字母).
A.100mL B.200mL C.500mL
(4)读数时需要注意(至少写两点)____________
(5)忽略水蒸气影响,在该条件下测得气体摩尔体积为Vm=____L/mol。(用含V的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿色化学”的理想状态是反应物的原子全部转化为目标产物。以下反应不符合绿色化学原则的是( )
A.工业生产环氧乙烷:![]()
B.水煤气合成甲醇:CO + 2H2 CH3OH
CH3OH
C.制取硫酸铜:Cu + 2H2SO4(浓)![]() CuSO4 + SO2↑+ 2H2O
CuSO4 + SO2↑+ 2H2O
D.合成甲基丙烯酸甲酯:CH3C≡CH + CO + CH3OH![]() CH2=C(CH3)COOCH3
CH2=C(CH3)COOCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由![]() 羟基丁酸生成
羟基丁酸生成![]() 丁内酯的反应如下:HOCH2CH2CH2COOH
丁内酯的反应如下:HOCH2CH2CH2COOH![]() +H2O
+H2O
在298K下,![]() 羟基丁酸水溶液的初始浓度为
羟基丁酸水溶液的初始浓度为![]() ,测得
,测得![]() 丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
丁内酯的浓度随时间变化的数据如表所示。回答下列问题:
| 21 | 50 | 80 | 100 | 120 | 160 | 220 |
|
| 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
(1)该反应在50~80min内的平均反应速率为_____![]() 。
。
(2)120min时![]() 羟基丁酸的转化率为______。
羟基丁酸的转化率为______。
(3)298K时该反应的平衡常数![]() _____。
_____。
(4)为提高![]() 羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
羟基丁酸的平衡转化率,除适当控制反应温度外,还可采取的措施是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com