
下列实验设计能够成功的是( )
A.检验亚硫酸钠试样是否变质:
试样 溶液
溶液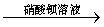 白色沉淀
白色沉淀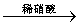 沉淀不溶解
沉淀不溶解
B.除去乙酸乙酯中混有的乙酸:
混合液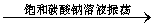 溶液分层
溶液分层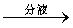 得上层液体
得上层液体
C.证明酸性条件下H2O2氧化性比I2强:
NaI溶液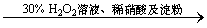 溶液变蓝色
溶液变蓝色
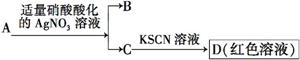
D.鉴定盐A的成分是FeBr2:
科目:高中化学 来源: 题型:
下列事实中,不能用勒夏特列原理解释的是
A.盛有NO2和N2O4 混合气体的烧瓶置于热水中,气体颜色变深
B .工业合
.工业合 成氨选择500oC左右的
成氨选择500oC左右的 温度比室温有利
温度比室温有利
C.实验室中常用排饱和食盐水的方法收集Cl2
D.合成氨时采用循环操作及将氨液化分离,可提高原料的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)在一次化学晚会上,一位同学表演了一个有趣的魔术:用蘸有饱和硫酸铜溶液的玻璃棒在一洁净的铁片上点上数处,所点之处,点铁成“金”。你知道其中的奥妙吗?请用化学方程式表示其反应原理:
__________________________________________________________________。
(2)铜在自然界多以+1价矿石存在,因为在固态或是高温下+1价铜比+2价铜稳定。辉铜矿(Cu2S)炼铜的方法之一是将矿石高温通空气焙烧,生成两种氧化物。将焙烧过的矿石加上比它质量约少一半的未经焙烧的矿石,混合后隔绝空气再进行高温熔烧,结果得到金属铜和一种具有刺激性气味的气体。这两个反应的化学方程式为 、 。
(3)已知CuS、Cu2S均为黑色不溶于水的固体,在空气中灼烧均生成CuO与SO2,不用其他试剂,设计最简单的实验来鉴别二者: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组溶液中,用括号内的试剂及物质间相互反应不能鉴别的一组
是( )
A.Ba(OH)2、KSCN、NaCl、Mg(NO3)2(FeCl3溶液)
B.NaNO3、NaHCO3、(NH4)2SO3、Na2SiO3(H2SO4溶液)
C.NH4Br、K2CO3、NaI、CaCl2(AgNO3溶液)
D.(NH4)3PO4、NaBr、CuSO4、AlCl3(KOH溶液)
查看答案和解析>>
科目:高中化学 来源: 题型:
为了将混有K2SO4、MgSO4的KNO3固体提纯,并制得纯净的KNO3溶液,某学生设计如下实验方案:
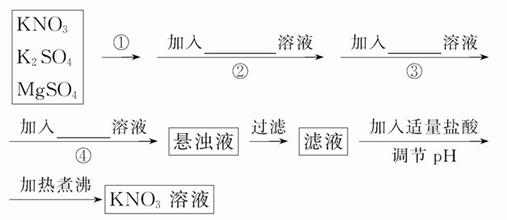
(1)操作①为 。
(2)操作②~④加入的试剂依次可以为:_________________________________。
(3)如何判断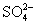 已除尽? ____________________________________________。
已除尽? ____________________________________________。
(4)实验过程中产生的多次沉淀__________(填“需要”或“不需要”)多次过滤,其理由是________________________________________________________。
(5)该同学的实验设计方案是否严密?请说明理由: _______________________
___________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验方案不能达到实验目的的是( )
| 实验目的 | 实验方案 | |
| A | 证明溴乙烷发生消去反应有乙烯生成 | 向试管中加入适量的溴乙烷和NaOH的乙醇溶液,加热,将反应产生的气体通入溴的四氯化碳溶液 |
| B | 证明Mg(OH)2沉淀可以转化为Fe(OH)3沉淀 | 向2 mL 1 mol·L-1NaOH溶液中先加入3滴1 mol·L-1MgCl2溶液,再加入3滴 1 mol·L-1FeCl3溶液 |
| C | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,然后加入足量稀NaOH溶液,再向其中加入新制的银氨溶液,并水浴加热 |
| D | 探究温度对化学平衡的影响 | 将NO2球浸泡在冷、热水中,观察颜色的变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知某温度下,反应SO2(g)+NO2(g)  SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是( )
SO3(g)+NO(g)的平衡常数K=0.24,下列说法正确的是( )
A.该温度下反应2SO2(g)+2NO2(g)  2SO3(g)+2NO(g)的平衡常数为0.48
2SO3(g)+2NO(g)的平衡常数为0.48
B.若该反应ΔH<0,则升高温度化学平衡常数K减小
C.若升高温度,逆反应速率减小
D. 改变条件使平衡正向移动,则平衡时n(NO2)/n(NO)一定比原平衡小
查看答案和解析>>
科目:高中化学 来源: 题型:
LED系列产品是被看好的一类节能新产品, 下图是一种氢氧燃料电池驱动LED发光的装置。下列有关叙述正确的是 ( )
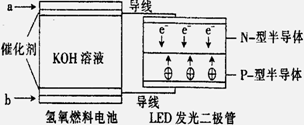
A.a处通入氢气,发生了还原反应: H2-2e-+2OH-=2H2O
B.b处通入氧气,为电池的正极
C.该装置中只涉及两种形式的能量转化,电池中的KOH溶液也可用稀硫酸溶液代替
D.P-型半导体连接的是电池负极
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.石炭酸与NaOH溶液混合: H+ + OH—  H2O
H2O
B.稀HNO3洗涤试管中的银镜:Ag + NO3— + 2H+ == Ag+ + NO↑ + H2O
C.乙烯使酸性KMnO4褪色:5C2H4 + 12MnO4— + 36H+ 12Mn2++ 10CO2↑ + 28H2O
12Mn2++ 10CO2↑ + 28H2O
D.向CH2BrCOOH中加入足量的氢氧化钠溶液并加热:
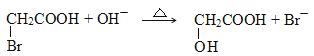
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com