
分析 (1)根据题干信息推导出甲、乙、丙三种物质,粉末仅含Na、Fe、N、O四种元素.水溶性试验表明,固体粉末部分溶解.经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于盐酸说明为氧化铁,在四种元素组成的单质中,可以在高温隔绝空气的条件下与Fe2O3反应的就只有金属钠了,因此单质乙是钠,化合物甲是由Na和N元素组成,由分解的甲的质量和产生的氮气体积确定甲的分子式;
(2)根据物质的性质来书写化学方程式,因为丙是在高温隔绝空气的条件下生成的,在根据丙的性质可知丙只能是Na2O;
(3)根据单质和红棕色粉末发生的置换反应来分析,钠和氧化铁发生的置换反应生成铁和氧化钠,安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠;
(4)根据红棕色粉末氧化铁的作用来寻找可替代的物质,需要和钠发生反应;
(5)根据可溶盐的可能组成情况结合盐的性质进行检验,氧化钠跟空气接触所得的可溶性的盐成分可能是Na2CO3,或NaHCO3,或Na2CO3与NaHCO3混合物,依据碳酸氢钠受热分解的性质设计实验检验.
解答 解:(1)Na、Fe、N、O四种元素组成的化合物中为红棕色且可溶于盐酸的只有Fe2O3,在四种元素组成的单质中,可以在高温隔绝空气的条件下与Fe2O3反应的就只有金属钠了,因此单质乙是钠,化合物甲是由Na和N元素组成,13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积为6.72L,即0.3mol,经计算知Na和N的原子个数比是1:3,所以化合物甲的化学式为NaN3,是一种离子化合物,故填:NaN3,
故答案为:NaN3;
(2)因为丙是在高温隔绝空气的条件下生成的,在根据丙的性质可知丙只能是Na2O而不是Na2O2,反应的化学方程式为:Na2O+2CO2+H2O=2NaHCO3,故填:Na2O+2CO2+H2O=2NaHCO3,
故答案为:Na2O+2CO2+H2O=2NaHCO3;
(3)钠和氧化铁发生的置换反应方程式为:6Na+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3Na2O,所以安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠,避免分解产生的金属钠可能产生的危害,故填:6Na+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3Na2O、避免分解产生的金属钠可能产生的危害,
故答案为:6Na+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+3Na2O;避免分解产生的钠可能产生危害;
(4)安全气囊中氧化铁粉末的作用是消耗产生的活泼的钠,硝酸钾本身受热分解产生氧气,可以和金属钠反应,选项中能和钠反应的还有氧化铜,故选B,
故答案为:B;
(5)氧化钠跟空气接触所得的可溶性的盐成分可能是Na2CO3,或NaHCO3,或Na2CO3与NaHCO3混合物,碳酸氢钠受热容易分解,碳酸钠受热稳定,故可以用加热的办法来确定成分,故填:可溶性盐的成分可能是Na2CO3,或NaHCO3,或Na2CO3与NaHCO3混合物;准确称取一定量的生成物.加热至恒重后,如果试样无失重,则为Na2CO3;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为NaHCO3,或Na2CO3与NaHCO3混合物,
故答案为:可溶性盐的成分可能是Na2CO3或NaHCO3或Na2CO3与NaHCO3的混合物.准确称取一定量的生成物,加热至恒重后,如试样无失重,则为Na2CO3;如加热后失重,根据失重的量在试样总质量中的比例,即可推断出试样为NaHCO3或Na2CO3与NaHCO3的混合物;
点评 本题以推断题的形式考查学生元素和化合物的知识,是一道综合知识题目,难度较大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
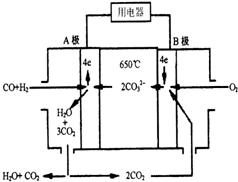 现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.
现有一个碳酸盐燃料电池,以一定比例的Li2CO3和Na2CO3低熔混合物为电解质,操作温度为650℃,在此温度下以镍为催化剂,直接以水煤气(CO、H2的体积比为1:1)为燃料,其工作原理如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等浓度的①(NH4)2SO4溶液、②NH4HCO3溶液、③NH4Cl溶液中的c(NH4+):①>③>② | |
| B. | 等体积pH=a的醋酸与pH=b的NaOH溶液(a+b=14)充分混合时,可能有:c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | 已知Ka(HClO)=3.0×10-8,Ka(HCN)=6.2×10-10,等体积、等浓度的NaClO、NaCN溶液中,前者中的离子总数小于后者中的离子总数 | |
| D. | 向20mL氨水中加入10mL等浓度的盐酸,有c(NH4+)-c(NH3•H2O)=2[c(OH-)-c(H+)] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和滴定实验中,锥形瓶须用待测液润洗 | |
| B. | 用广泛pH试纸测得某溶液的pH为2.3 | |
| C. | 用标准盐酸溶液滴定未知浓度NaOH溶液时,若滴定前滴定管尖嘴处有气泡未排出而滴定后消失,则能使所测结果偏高 | |
| D. | 滴定时可将KMnO4溶液装在碱式滴定管中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 | 0 | 20 | 40 | 60 | 80 | 100 | 120 |
| T1 | 2100 | 1052 | 540 | 199 | 8.7 | 0.06 | 0.06 |
| T2 | 2100 | 869 | 242 | x | x | x | x |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
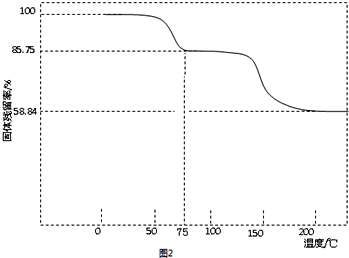
| 实验内容 | 实验方法 | 实验现象及原因分析 |
| ①碘离子浓度增大对平衡的影响 | 取PbI2饱和溶液少量于一支试管中,再滴入几滴NaI饱和溶液 | 现象:溶液中c(I-)增大,使Q大于了PbI2的Ksp |
| ②铅离子浓度减小对平衡的影响 | 取PbI2悬浊液少量于一支试管中,再加入少量NaCl饱和溶液 | 现象:黄色浑浊消失 原因:形成PbCl42-,导致溶液中c(Pb2+)减小,使Qc小于PbI2的Ksp |
| ③铅离子和碘离子浓度都减小对平衡的影响 | 在PbI2悬浊液中滴入几滴FeCl3饱和溶液 | 现象:黄色浑浊消失 写出反应的离子方程式:PbI2+2Fe3++4Cl-=PbCl42-+2Fe2++I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
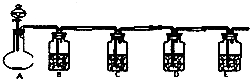 设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示:
设计一实验将只含有Na2SO4、Na2SO3、Na2CO3的白色固体中的三种成分检验出来.取一定量的白色固体与烧瓶A中,通过分液漏斗加入液体a,如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将FeCl2溶液在空气中加热蒸干并灼烧,最终得到黑色FeO固体 | |
| B. | 同浓度的氨水,NH4Cl、(NH4)2SO4溶液中水电离出氢离子浓度相同 | |
| C. | 一定浓度的氨水和盐酸混合存在关系:c(NH4+)+c(H+)=c(OH-)+c(Cl-) | |
| D. | 室温下,0.1mol/L的HA溶液中$\frac{c({H}^{+})}{c(O{H}^{-})}$=1010,则NaA溶液显酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com