
【题目】在3S + 6KOH === 2K2S + K2SO3 + 3H2O的反应中,被氧化的硫和被还原的硫的质量比是
A. 2∶ 1 B. 2∶ 3 C. 1∶ 2 D. 3∶1
【答案】C
【解析】
反应3S + 6KOH === 2K2S + K2SO3 + 3H2O中,只有S元素的化合价发生变化,S→K2S,化合价降低,被还原,S→K2SO3,化合价升高,被氧化,根据氧化剂与还原剂得失电子数目相等计算。
在化学反应方程式3S + 6KOH === 2K2S + K2SO3 + 3H2O中,只有S元素的化合价发生变化,氧化剂和还原剂都是S,假设有3 mol S参与反应,则在S→K2S反应中,化合价降低的S原子为2 mol,即被还原的S为2 mol;在S→K2SO3反应中,化合价升高的S原子为1 mol,则被氧化的S为1 mol,被氧化与被还原的硫原子的物质的量之比为1:2,根据n = ![]() 可知,被氧化的硫和被还原的硫的质量比也为1:2,
可知,被氧化的硫和被还原的硫的质量比也为1:2,
答案选C。


科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值。下列叙述中正确的是( )
A. 分子总数为NA的二氧化硫和二氧化碳混合气体中含有的原子数为3NA
B. 任何条件下,20 L 氧气含有的分子数都不可能为NA
C. 在标准状况下,2 g氖气含有NA个氖原子
D. 物质的量相等的任何气体中都含有相同的原子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种由菱镁矿(主要成分MgCO3、CaCO3、FeCO3、SiO2)制备高纯氢氧化镁的工艺如下:

(1)“煅烧”时FeCO3发生反应的方程式为_____。
(2)“浸取”温度100℃左右,该步骤含镁化合物参与反应的化学方程式为______。
(3)“浸取”时NH4Cl用量对Mg2+浸出率的影响曲线如右图所示。下列有关说法正确的____(填序号)。

A.“浸取”时适当搅拌浆料
B.用超理论用量20%的NH4Cl进行浸取
C.可用NH4Cl对浸取后的滤渣进行二次浸取,将两次浸取液合并
D.浸出温度采用100℃可促进NH4Cl的水解和NH3的逸出
(4)本工艺流程中可循环利用的物质有______。
(5)若要得到高纯Mg(OH)2,需对“沉镁”步骤所得的固体进行洗涤,检验固体已洗净的方法是_______。
(6)25℃时,Ksp(CaSO4)=7.2×10-5。实验测得“除钙”前后溶液中c(Ca2+)分别为2.8g/L和0.8g/L,则1L溶液至少需加入MgSO4固体的质量为____g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() 在酸性溶液中易被还原成
在酸性溶液中易被还原成![]() ,且
,且![]() 、
、![]() 、
、![]() 、
、![]() 的氧化性依次减弱。下列叙述中,正确的是
的氧化性依次减弱。下列叙述中,正确的是
A. ![]() 通入
通入![]() 溶液中,可存在反应3
溶液中,可存在反应3![]() +6
+6![]() ====2
====2![]() +4
+4![]()
B. 每1 mol ![]() 在酸性溶液中被氧化生成
在酸性溶液中被氧化生成![]() 时转移2 mol
时转移2 mol ![]()
C. ![]() 溶液能将KI溶液中的I-氧化
溶液能将KI溶液中的I-氧化
D. I2具有较强的氧化性,可以将![]() 氧化成
氧化成![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用自来水养金鱼,在将水注入鱼缸之前,常需把水在阳光下晒一段时间,主要目的是( )
A.增加水中氧气的含量
B.起杀菌作用
C.使水中的次氯酸分解
D.使水的温度升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰氧基胡椒酚乙酸酯(F)具有抗氧化性、抗肿瘤作用,其合成路线如下:
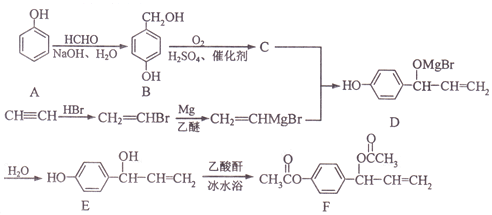
已知:RMgBr![]()
(1)化合物F中含氧官能团的名称为______。
(2)A-B的反应类型为_______。
(3)化合物C的结构简式为______。
(4)1mol化合物E与足量乙酸酐[(CH3CO)2O]反应,除F外另一产物的物质的量为_______。
(5)写出同时满足下列条件的E的一种同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应;
③核磁共振氢谱显示有4种不同化学环境的氢,其峰面积比为6:2:1:1。
(6)请以甲苯和乙醛为原料制备![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用钒炉渣(主要含FeO·V2O5,还有少量SiO2、P2O5等杂质)提取V2O5的流程如下:

(1)焙烧的目的是将FeO·V2O3转化为可溶性NaVO3,该过程中被氧化的元素是_______________;浸出渣的主要成分为____________________(填化学式)。
(2)用MgSO4溶液除硅、磷时,滤渣的主要成分为__________。
(3)在焙烧NH4VO3的过程中,固体质量的减少值(纵坐标)随温度变化的曲线如图所示,210℃时,剩余固体物质的化学式为_____________________。

(4)由V2O5冶炼金属钒采用铝热法,引发铝热反应的实验操作是__________________.
(5)将V2O5溶于足量稀硫酸得到250mL(VO2)2SO4溶液。取25.00mL该溶液于锥形瓶中,用0.1000 mol·L-1H2C2O4标准溶液进行滴定,达到滴定终点时消耗标准溶液的体积为20.00mL。已知滴定过程中H2C2O4被氧化为CO2,VO2+(黄色)被还原为VO2+(蓝色)。
①该滴定实验不需要另外加入指示剂,达到滴定终点的现象是___________________。
②(VO2)2SO4溶液中溶质的物质的量浓度为___________________。
③达到滴定终点时,俯视滴定管读数将使结果_________(填“偏高”、“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 氯气通入水中: Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向苯酚浊液中滴加Na2CO3溶液:2C6H5OH+CO32-=2C6H5O-+H2O+CO2↑
C. 向偏铝酸钠溶液中加入NaHCO3溶液: AlO2-+HCO3-+H2O=Al(OH)3↓+CO32-
D. 碳酸氢铵溶液中加入足量NaOH溶液共热: NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人类较早使用的金属之一.运用铁及其化合物的知识,完成下列问题.
(1)所含铁元素既有氧化性又有还原性的物质是_______(用字母代号填).
A.Fe B.FeCl3 C.FeSO4 D.Fe2O3
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,该分散系中粒子直径的范围是_________nm.
(3)中国古代四大发明之一的指南针是由天然磁石制成的,其主要成分是____________。
(4)我国早在春秋战国就开始生产和使用铁器,写出工业上用赤铁矿为原料炼铁的化学方程式:_______________________________。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。Fe(OH)3与KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com