反应N2+3H2═2NH3刚开始时,N2的浓度为3mol/L,H2的浓度为5mol/L.3min后测得NH3浓度为0.6mol/L,则此时间内,下列反应速率表示正确的是( )
A.v(NH3)=0.2 mol/
B.v(N2)=1.0mol/
C.v(H2)=1.67 mol/
D.v(H2)=0.3 mol/
【答案】
分析:3min后测得NH
3浓度为0.6mol/L,则v(NH
3)=

=0.2mol/(L?min),然后结合反应速率之比等于化学计量数之比来解答.
解答:解:3min后测得NH
3浓度为0.6mol/L,则v(NH
3)=
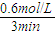
=0.2mol/(L?min),
A.v(NH
3)=0.2 mol/(L.min),故A错误;
B.v(N
2)=0.2 mol/(L.min)×

=0.1mol/(L?min),故B错误;
C.v(H
2)=0.2 mol/(L.min)×

=0.3mol/(L?min),故C错误;
D.v(H
2)=0.2 mol/(L.min)×

=0.3mol/(L?min),故D正确;
故选D.
点评:本题考查化学反应速率的计算及反应速率与化学计量数的关系,明确反应速率之比等于化学计量数之比即可解答,注重基础知识的考查,题目难度不大.

 =0.2mol/(L?min),然后结合反应速率之比等于化学计量数之比来解答.
=0.2mol/(L?min),然后结合反应速率之比等于化学计量数之比来解答.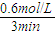 =0.2mol/(L?min),
=0.2mol/(L?min), =0.1mol/(L?min),故B错误;
=0.1mol/(L?min),故B错误; =0.3mol/(L?min),故C错误;
=0.3mol/(L?min),故C错误; =0.3mol/(L?min),故D正确;
=0.3mol/(L?min),故D正确;

 阅读快车系列答案
阅读快车系列答案
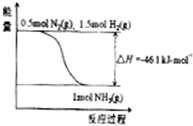 氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下:
氨在工农业生产中应用广泛.在压强为30MPa时,合成氨平衡混合气体中NH3的体积分数如下: