
【题目】对硝基甲苯是医药、染料等工业的一种重要有机中间体,它常以浓硝酸为硝化剂,浓硫酸为催化剂,通过甲苯的硝化反应制备。
![]()
![]()
![]() +
+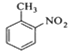 +
+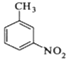
一种新的制备对硝基甲苯的实验方法是:以发烟硝酸为硝化剂,固体NaHSO4为催化剂(可循环使用),在CCl4溶液中,加入乙酸酐(有脱水作用),45℃反应1h 。反应结束后,过滤,滤液分别用5% NaHCO3溶液、水洗至中性,再经分离提纯得到对硝基甲苯。
(1)上述实验中过滤的目的是___________。
(2)滤液在分液漏斗中洗涤静置后,有机层处于________层(填“上”或'下”)。
(3)5% NaHCO3溶液洗涤的目的是__________
(4)下列给出了催化剂种类及用量对甲苯硝化反应影响的实验结果。
催化剂 | n(催化剂)/n(甲苯) | 硝化产物中各种异构体质量分数(%) | 总产率(%) | ||
对硝基甲苯 | 邻硝基甲苯 | 间硝基甲苯 | |||
浓H2SO4 | 1.0 | 35.6 | 60.2 | 4.2 | 98.0 |
1.2 | 36.5 | 59.5 | 4.0 | 99.8 | |
NaHSO4 | 0.15 | 44.6 | 55.1 | 0.3 | 98.9 |
0.25 | 46.3 | 52.8 | 0.9 | 99.9 | |
0.32 | 47.9 | 51.8 | 0.3 | 99.9 | |
0.36 | 45.2 | 54.2 | 0.6 | 99.9 | |
①NaHSO4催化制备对硝基甲苯时,催化剂与甲苯的最佳物质的量之比为_______________。
②由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是_________________。
③与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有_____________。
【答案】回收NaHSO4 下 除去过量的乙酸酐(或乙酸)、硝酸 0.32 甲苯硝化主要得到对硝基甲苯和邻硝基甲苯 在硝化产物中对硝基甲苯比例提高 催化剂用量少且能循环使用
【解析】
(1)固体NaHSO4为催化剂,故上述实验中过滤的目的是回收NaHSO4;
(2)滤液在分液漏斗中洗涤静置后,由于硝基苯的密度比水大,有机层处于下层;
(3)滤液中含硝酸和过量的乙酸酐,可以用碱或者碱性物质洗去,故5% NaHCO3溶液洗涤的目的是除去滤液中过量的乙酸酐(或乙酸)、硝酸;
(4) ①根据表中数据,NaHSO4催化制备对硝基甲苯时,当催化剂与甲苯的物质的量之比为0.32,目标产物对硝基甲苯的含量最高,故催化剂与甲苯的最佳物质的量之比为0.32;②根据表中数据,由甲苯硝化得到的各种产物的含量可知,甲苯硝化反应的特点是主要得到对硝基甲苯和邻硝基甲苯;③根据表中数据对比,与浓硫酸催化甲苯硝化相比,NaHSO4催化甲苯硝化的优点有在硝化产物中对硝基甲苯比例提高 催化剂用量少且能循环使用。


科目:高中化学 来源: 题型:
【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400 mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气,实验记录如下(累计值):
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL(标准状况) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大________min(填“0~1”,“1~2”,“2~3”,“3~4”或“4~5”),原因是_____。
②求3~4 min时间段以盐酸的浓度变化来表示的该反应速率______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入等体积的下列溶液以减慢反应速率,你认为不可行的是________(填字母)。
A.蒸馏水 B.KCl溶液
C. KNO3溶液D.Na2SO4溶液
(3)某温度下在4 L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图。
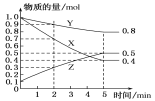
①该反应的化学方程式是_________。
②该反应达到平衡状态的标志是____(填字母)。
A.Y的体积分数在混合气体中保持不变
B.X、Y的反应速率比为3∶1
C.容器内气体压强保持不变
D.容器内气体的总质量保持不变
E.生成1 mol Y的同时消耗2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定![]() 样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用
样品的纯度,用硫酸溶解6.300 g样品,定容至250 mL。取25.00 mL溶液,用![]() 标准溶液滴定至终点。重复实验,数据如下:
标准溶液滴定至终点。重复实验,数据如下:
序号 | 滴定前读数/mL | 滴定终点读数/mL |
1 | 0.00 | 19.98 |
2 | 1.26 | 22.40 |
3 | 1.54 | 21.56 |
已知:![]()
假设杂质不参加反应。
该样品中![]() 的质量分数是________%(保留小数点后一位);
的质量分数是________%(保留小数点后一位);
写出简要计算过程:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醛能够发生下列反应:
Cu2O+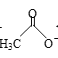
![]()
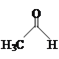
![]()
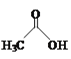
![]()
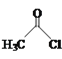
(1)Mn2+的基态电子排布式为____。
(2)氯化亚砜(SOCl2)是有机合成中重要的氯化剂,与SOCl2互为等电子体的阴离子的化学式为___。
(3)CH3CHO分子中氧原子的轨道杂化类型是____。
(4)乙酸的沸点(117.9 ℃)比乙醛的沸点(20.8 ℃)高的主要原因是____。
(5)不考虑空间构型,[Cu(OH)4]2-的结构可用示意图表示为____。
(6)如图表示Cu2O的晶胞,Cu+的配位数是____。
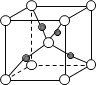
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钠(Na2FeO4)具有很强的氧化性,是一种新型的绿色净水消毒剂。工业上以菱铁矿(主要成分是FeCO3及少量SiO2)为原料制备高铁酸钠生产过程如下:
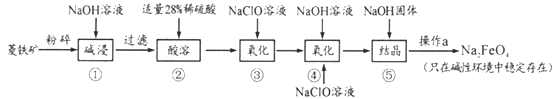
(1)Na2FeO4中铁元素的化合价为___,高铁酸钠用于杀菌消毒时的化学反应类型为____(填“氧化还原反应”、“复分解反应”或“化合反应”)。
(2)按照上述流程,步骤①中碱浸时能否用较便宜的Ca(OH)2替代NaOH_____(填“能”或“不能”),理由是___________。
(3)步骤②中28%的稀硫酸需要用98%的浓硫酸配制,配制时所需玻璃仪器除量筒外,还____(填字母序号)。步骤③中检验Fe2+全部转化成Fe3+的方法是:__________。
A.容量瓶 B.烧杯 C.烧瓶 D.玻璃棒 E.酸式滴定管;
(4)步骤④中除生成Na2FeO4外,还有NaCl生成,其离子方程式为_________;己知步骤⑤是向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液,则操作a的名称为_____。
(5)理论上,每获得0.5mol的FeO42-消耗 NaClO的总质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸罗替戈汀是一种用于治疗帕金森病的药物,其合成路线流程图如下:
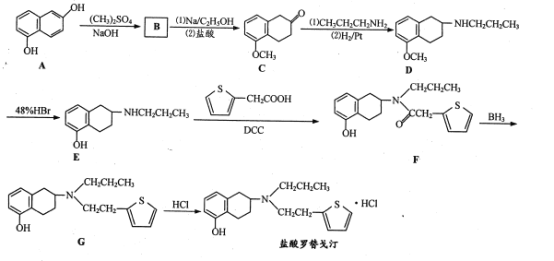
(1)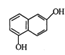 、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
、CH3CH2CH2NH2中所含官能团的名称分别为 ______、 ________。
(2)D→E的反应类型是_______。
(3)B的分子式为C12H12O2,写出B的结构简式;____ 。
(4)C的一种同分异构体X同时满足下列条件,写出X的结构简式:_______。
①含有苯环,能使溴水褪色;
②能在酸性条件下发生水解,水解产物分子中所含碳原子数之比为6:5,其中一种水解产物分子中含有3种不同化学环境的氢原子。
(5)已知:![]()
![]() R3COOH+
R3COOH+![]() ,写出以
,写出以![]() 和
和![]() 为原料制备
为原料制备 的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图_______(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为探究SO2的性质,按下图所示装置进行实验。

请到答F列问题:
(1)装置A中盛放亚硫酸钠的仪器名称是 ,其中发生反应的化学方程式为 ;
(2)实验过程中,装置B、C中发生的现象分别是 、 ,这些现象分别说明SO2具有的性质是 和 ;装置B中发生反应的离子方程式为 ;
(3)装置D的目的是探究SO2与品红作用的可逆性,请写出实验操作及现象 ;
(4)尾气可采用 溶液吸收。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水中含有丰富的资源,其中包括钠离子、氯离子、镁离子等。
(1)氯元素位于元素周期表第________列,写出氯原子的最外层电子排布式________________, 最外层电子所占据的轨道数为________ 个,氯原子核外共有________种能量不同的电子。
(2)列举能说明Mg的金属性比Na弱的一个实验事实__________________。
(3)相同压强下,部分元素氟化物的熔点见下表:
氟化物 | NaF | MgF2 | SiF4 |
熔点/℃ | 1266 | 1534 | 183 |
试解释上表中熔点SiF4远低于NaF的原因_________________________
(4)氨水是实验室最常用的弱碱,向滴有少量酚酞试液的稀氨水,加入少量的NH4AC晶体,若观察到________________则可证明一水合氨是弱电解质。请再提出一个能证明一水合氨是弱电解质的实验方案 ______________________________________
(5)向盐酸中滴加氨水至过量,该过程所发生反应的离子方程式为___________________
在滴加的整个过程中离子浓度大小关系可能正确的是(______)
a.c(C1-)=c(NH4+)>c(H+)=c(OH-) b.c(C1-)>c(NH4+)= c(OH-) >c(H+)
c.c(NH4+)>c(OH-)>c(C1-)>c(H+) d.c(OH-)>c(NH4+)>c(H+)>c(C1-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关电解质溶液的说法正确的是
A.NaHCO3溶液加水稀释,c(Na+)与c(HCO3)的比值将减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中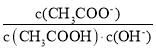 增大
增大
C.同浓度的下列溶液:①NH4Al(SO4)2 ②NH4Cl ③NH3·H2O ④CH3COONH4,其中c(NH4+)由大到小的是:①>④>②>③
D.常温下将pH=2的盐酸与pH=13的Ba(OH)2溶液混合后,所得溶液的pH=11,则盐酸与Ba(OH)2溶液的体积比为9:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com