
| A. | KCl | B. | Na2SO4 | C. | FeCl3 | D. | BaCl2 |
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:选择题
| A. | Al2O3熔点高,可用作耐高温材料 | B. | SiO2能与HF反应,可用作光导纤维 | ||
| C. | KAl(SO4)2易溶于水,可用作净水剂 | D. | Fe2O3能与酸反应,可用作红色涂料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3溶液中:K+、Na+、SO42-、SCN- | |
| B. | 在强碱性溶液中:K+、Na+、CO3-、AlO2- | |
| C. | 在盐酸溶液中:K+、Fe2+、SO32-、NO3- | |
| D. | 与铝反应产生氢气的溶液中:Na+、K+、HCO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 电离能/kJ•mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
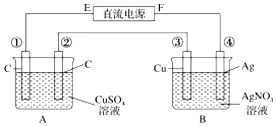 如图所示,通电5min后,第③极增重2.16g,此时CuSO4恰好电解完.设A池中原混合溶液的体积为200mL.
如图所示,通电5min后,第③极增重2.16g,此时CuSO4恰好电解完.设A池中原混合溶液的体积为200mL.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
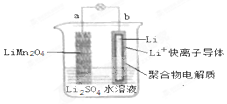 2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )
2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系,放电时,该电池的反应为 Li1-xMn2O4+xLi=LiMn2O4.则下列叙述错误的是( )| A. | a 为电池的正极 | |
| B. | 电池充电反应为 LiMn2O4=Li1-xMn2O4+xLi | |
| C. | 放电时,a 极锂的化合价发生变化 | |
| D. | 放电时,溶液中 Li+从 b 向 a 迁移 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 操作 |
| A | 比较水和乙醇中羟基氢的活泼性强弱 | 用金属钠分别与水和乙醇反应 |
| B | 验证淀粉已水解 | 向淀粉溶液中加入稀硫酸,水浴加热,一段时间后,再加入新制的氢氧化铜悬浊液并加热 |
| C | 比较Mg和Al的金属活动性强弱 | 分别用镁、铝为电极,氢氧化钠为电解质的原电池装置中反应现象 |
| D | 除去苯中混有的苯酚 | 向混合液中加入过量浓溴水,充分反应后,过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9种 | B. | 8种 | C. | 7种 | D. | 6种 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com