
(10分)50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液进行中和反应,通过测定反应过程中所放出的热量可计算中和热。
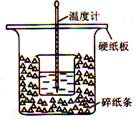
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃用品是 。
(2)烧杯间填满碎纸条的作用是 。
(3)大烧杯如不盖硬纸板,测得的中和热数值 (填“偏大”、“偏小”或“无影响”)
(4)实验中改用60mL 0.50mol/L盐酸跟50mL0.55mol/LNaOH溶液进行反应,与上述实验相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”),简述理由 。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得中和热的数值会 (填“偏大”、“偏小”或“无影响”);用50mL 0.50mol/L NaOH溶液进行上述实验,测得的中和热的数值会 (填“偏大”、“偏小”或“无影响”)。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
 50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:
(1)50mL 0.50mol/L盐酸与50mL 0.55mol/L NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热,回答下列问题:| 滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
| 滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
| 第一次 | 10.00 | 0.40 | 20.50 |
| 第二次 | 10.00 | 4.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室用50mL 0.50mol?L-1盐酸、50mL 0.55mol?L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:
实验室用50mL 0.50mol?L-1盐酸、50mL 0.55mol?L-1 NaOH溶液和如图所示装置,进行测定中和热的实验,得到表中的数据:| 实验次数 | 起始温度t1/℃ | 终止温度t2/℃ | |
| 盐酸 | NaOH溶液 | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某同学用如图装置做中和热的测定实验
某同学用如图装置做中和热的测定实验查看答案和解析>>
科目:高中化学 来源: 题型:
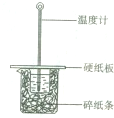 某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在有图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热.下列说法正确的是( )
某同学用50mL 0.50mol/L的盐酸与50mL 0.55mol/L的NaOH溶液在有图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算中和热.下列说法正确的是( )| A、实验过程中没有热量损失 | B、烧杯间填满碎纸条的作用是固定小烧杯 | C、图中实验装置缺少环形玻璃搅拌棒 | D、若将盐酸体积改为60mL,理论上所求中和热不相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com