
分析 根据n=$\frac{m}{M}$计算Al3+ 的物质的量,而n(SO42-)=$\frac{3}{2}$n(Al3+),计算$\frac{V}{4}$mL溶液中SO42-的物质的量,再根据c=$\frac{n}{V}$计算.
解答 解:ag Al3+ 的物质的量为$\frac{ag}{27g/mol}$=$\frac{a}{27}$mol,而n(SO42-)=$\frac{3}{2}$n(Al3+)=$\frac{a}{18}$mol,则$\frac{V}{4}$mL溶液中SO42-的物质的量=$\frac{a}{18}$mol×$\frac{1}{4}$=$\frac{a}{72}$mol,则$\frac{V}{4}$mL溶液稀释到VmL,稀释后溶液中SO42-的物质的量浓度是$\frac{\frac{a}{72}}{V×1{0}^{-3}}$=$\frac{125a}{9V}$mol/L,故答案为:$\frac{125a}{9V}$mol/L.
点评 本题考查物质的量有关计算,注意对物质的量浓度定义式理解与灵活应用,难度不大.


科目:高中化学 来源: 题型:实验题
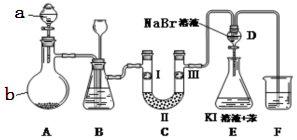
| 实验现象 | 原因 |
| 溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
| 随后溶液逐渐变为无色 | 氯气与水反应生成HClO具有漂白性 |
| 然后溶液从无色逐渐变为浅黄绿色 | 过量氯气溶解于水中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳场馆常用硫酸铜作池水消毒剂 | |
| B. | 高炉炼铁得到纯度高的铁,加入其他金属炼制得到钢 | |
| C. | 焙制糕点的发酵粉主要成分之一是碳酸氢钠,它也是治疗胃酸过多的一种药剂 | |
| D. | 分子筛常用于分离、提纯气体或液体混合物,还可作干燥剂、离子交换剂、催化剂及催化剂载体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图所示,试管中放一枚铁钉,并盛放一定量的NaCl溶液,导管中有少量蒸馏水.
如图所示,试管中放一枚铁钉,并盛放一定量的NaCl溶液,导管中有少量蒸馏水.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将78gNa2O2与过量CO2反应转移的电子数为2NA | |
| B. | 1mol N2与 4mol H2反应生成的NH3 分子数为2NA | |
| C. | 标准状况下,2.24L SO3中所含原子数为0.4 NA | |
| D. | 标准状况下,18g D2O中所含电子数为9 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com