
 (1)腐蚀电路板的反应为:Cu+2FeCl3=CuCl2+2FeCl2,
(1)腐蚀电路板的反应为:Cu+2FeCl3=CuCl2+2FeCl2,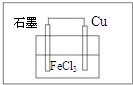 ,故答案为:
,故答案为: ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲烷、甲醇 |
| B、乙烯、环丙烷 |
| C、乙炔、苯 |
| D、乙醇、丙烯酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| B | E | F | |
| 起始组成/mol | 2 | 4 | 0 |
| 某时刻组成/mol | 1 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某无色溶液中加入稀盐酸,无明显变化,再加入Ba(NO3)2溶液后,产生白色沉淀,说明原来溶液中含有SO42- |
| B、在稀硫酸中加入铜粉,铜粉不溶解;再加入Cu(NO3)2固体,铜粉仍不溶解 |
| C、向AlCl3溶液中滴加氨水,产生白色沉淀;再加入过量NaHSO4溶液,沉淀消失 |
| D、过量的锌与浓硫酸反应产生的气体是SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、① | B、③⑥ | C、②④⑥ | D、①③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH4+ NO3- CO32- Na+ |
| B、Na+ Ba2+ Mg2+ HCO3- |
| C、NO3- Ca2+ K+H+ |
| D、NO3- K+ AlO2- OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com