
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量试剂于洁净烧杯中,加入足量蒸馏水,充分搅拌,静置,过滤,得滤液和沉淀 | / |
| 步骤2:取适量步骤1滤液于试管中,滴加稀硫酸 | 生成白色沉淀,说明该试剂中含有Ba2+ |
| 步骤3:取适量步骤1中的沉淀于是试管中,… | …,说明该试剂中含有BaCO3 |
| 步骤4:… | … |
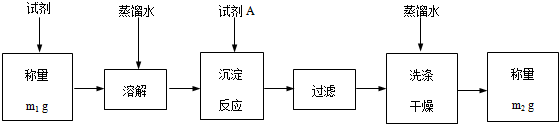
分析 (1)Ba(OH)2•8H2O与CO2作用转化为BaCO3;
(2)步骤3:取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中;
预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
(3)步骤4:步骤2仅验证试剂中含有Ba2+离子,要说明试剂中有Ba(OH)2,则还要证明试剂中含有OH-离子,根据室温时BaCO3饱和溶液pH=9.6,所以步骤4:取适量滤液于烧杯中,用pH计测其pH值;预期现象和结论:pH>9.6,说明有大量的OH-;
(4)根据氢氧化钡在溶解,过滤的过程中吸收空气中的二氧化碳,又产生碳酸钡,对最终测定Ba(OH)2•8H2O的含量产生影响;
(5)根据测定方案可知,将已准确称量的试剂中Ba(OH)2•8H2O全部转化成BaCO3,再过滤、洗涤、干燥、称量,利用前后的质量差即Ba(OH)2•8H2O→BaCO3,从而计算出Ba(OH)2•8H2O的量,进一步计算试剂中Ba(OH)2•8H2O(式量:315)的质量分数,据此计算;
(6)根据相对误差=$\frac{实验值-准确值}{准确值}$计算结合试剂中Ba(OH)2•8H2O(式量:315)的质量分数=$\frac{315(m{\;}_{1}-m{\;}_{2})}{118m{\;}_{1}}$判断;
解答 解:(1)烧杯中未溶物仅为BaCO3,则由于Ba(OH)2•8H2O与CO2作用转化为BaCO3,方程式为:Ba(OH)2•8H2O+CO2=BaCO3+9H2O;
故答案为:Ba(OH)2•8H2O+CO2=BaCO3+9H2O;
(2)取适量步骤1中的沉淀于是试管中,滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中;预期现象和结论:试管中有气泡生成,烧杯中的澄清石灰水变浑浊,结合步骤2说明沉淀是BaCO3;
故答案为:滴加稀盐酸,用带塞导气管塞紧试管,把导气管插入装有澄清石灰水的烧杯中;试管中有气泡生成,烧杯中的澄清石灰水变浑浊;
(3)步骤4:取适量滤液于烧杯中,用pH计测其pH值;预期现象和结论:pH>9.6,说明有大量的OH-,则说明试剂中有Ba(OH)2,
故答案为:取适量滤液于烧杯中,用pH计测其pH值;pH>9.6,说明有大量的OH-;
(4)因为氢氧化钡在溶解,过滤的过程中吸收空气中的二氧化碳,又产生碳酸钡,对最终测定Ba(OH)2•8H2O的含量产生影响,所以该方法不可行,故答案为:氢氧化钡在溶解,过滤的过程中吸收空气中的二氧化碳,又产生碳酸钡,对最终测定Ba(OH)2•8H2O的含量产生影响;
(5)根据测定方案可知,将已准确称量的试剂中Ba(OH)2•8H2O全部转化成BaCO3,再过滤、洗涤、干燥、称量,利用前后的质量差即Ba(OH)2•8H2O→BaCO3,从而计算出Ba(OH)2•8H2O的量,进一步计算试剂中Ba(OH)2•8H2O(式量:315)的质量分数;
(1)根据以上分析试剂A为碳酸钠,过滤前,检验沉淀是否完全的操作是取上层清液,再滴入一滴试剂A,若无沉淀产生,说明沉淀完全;故答案为:碳酸钠;取上层清液,再滴入一滴试剂A,若无沉淀产生,说明沉淀完全;
(2)由Ba(OH)2•8H2O→BaCO3,△m减少
1mol 178-60=118g
$\frac{m{\;}_{1}-m{\;}_{2}}{118}$ m1-m2
所以该试剂中Ba(OH)2•8H2O(式量:315)的质量分数=$\frac{315(m{\;}_{1}-m{\;}_{2})}{118m{\;}_{1}}$,故答案为:$\frac{315(m{\;}_{1}-m{\;}_{2})}{118m{\;}_{1}}$;
(6)相对误差=$\frac{实验值-准确值}{准确值}$=$\frac{m{\;}_{2}-m{\;}_{3}}{m{\;}_{3}}$,当相对误差为负值时,说明实验值m2 偏小,则根据该试剂中Ba(OH)2•8H2O(式量:315)的质量分数=$\frac{315(m{\;}_{1}-m{\;}_{2})}{118m{\;}_{1}}$,所以Ba(OH)2•8H2O的含量测定结果偏大,故答案为:$\frac{m{\;}_{2}-m{\;}_{3}}{m{\;}_{3}}$;偏大.
点评 本题考查物质成分与含量测定、对实验方案的理解与设计、化学计算等,题目综合性较大,难度中等,侧重对实验方案设计与化学计算,是对学生综合能力的考查.


科目:高中化学 来源: 题型:选择题
| A. | NaHCO3溶液中:c (H+)+c (Na+)=c (OH-)+c (CO32-)+c (HCO3-) | |
| B. | 常温下,pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c (H+)<c (OH-) | |
| C. | 0.1 mol•L-1的NH4Cl溶液中:c (Cl-)>c (H+)>c (NH4+)>c (OH-) | |
| D. | 物质的量浓度相等的CH3COOH和CH3COONa溶液等体积混合后的溶液中:2c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小顺序:r(Z)>r(W)>r(X)>r(Y) | |
| B. | Y分别与Z、W形成的化合物中化学键类型相同 | |
| C. | X的最高价氧化物对应水化物的酸性比W的强 | |
| D. | Y的气态简单氢化物的热稳定性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.8×10-7 mol•L-1 | B. | 1.0×10-5 mol•L-1 | ||
| C. | 1.0×10-7 mol•L-1 | D. | 1.8×10-9 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:
铜是一种重要的有色金属,近年来用途越来越广泛.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.0 mol/L | B. | 0.6 mol/L | C. | 1.7 mol/L | D. | 1.2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 元素第一电离能大小:J>R>Q | |
| B. | 含T元素的两种盐的溶液,一定不能相互反应 | |
| C. | Z的含氧酸一定为强酸 | |
| D. | Q、R、J三元素中J的电负性最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2 g 氦气所含有的原子数目是0.25 NA | |
| B. | 常温常压下,0.5 mol Cl2所占有的体积约为11.2 L | |
| C. | 标准状况下,0.9 mL水的质量约为0.9 g | |
| D. | 0.5 mol/L Na2SO4 溶液中Na+ 的物质的量是1 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com