
【题目】阿伏加德罗常数为NA。关于 l00mLl mol/L的Fe2(SO4)3溶液,下列说法正确是
A.加NaOH可制得Fe(OH)3 胶粒0.2NA
B.溶液中阳离子数目为0.2NA
C.加Na2CO3 溶液发生的反应为 3CO32-+ 2Fe3+ = Fe2(CO3 )3↓
D.Fe2(SO4)3溶液可用于净化水
【答案】D
【解析】
A. Fe2(SO4)3加NaOH反应生成Fe(OH)3沉淀,而不是胶粒,故A错误;
B. l00mL l mol/L的Fe2(SO4)3溶液中n[Fe2(SO4)3] =1 molL1 ×0.1L =0.1mol,n(Fe3+)=0.2mol,铁离子水解 Fe3+ + 3H2O ![]() Fe(OH)3 + 3H+,根据水解方程式得到溶液中阳离子数目大于0.2NA,故B错误;
Fe(OH)3 + 3H+,根据水解方程式得到溶液中阳离子数目大于0.2NA,故B错误;
C. 加Na2CO3溶液发生双水解生成氢氧化铁沉淀和二氧化碳气体,其反应为 3CO32+ 2Fe3+ + 3H2O =2 Fe(OH)3↓ + 3CO2↑,故C错误;
D. Fe2(SO4)3溶液水解生成胶体,胶体具有吸附杂质功能,起净水功能,因此可用于净化水,故D正确。
综上所述,答案为D。


科目:高中化学 来源: 题型:
【题目】对于反应:4CO(g)+2NO2(g)=4CO2(g)+N2(g)△H=-1200KJ/mol,温度不同(T2>T1)其他条件相同时,下列图像正确的是

A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麻黄素是中枢神经兴奋剂,其合成路线如图所示。
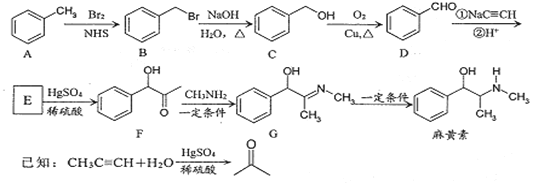
(1)F中的含氧官能团名称为 ________和________。
(2)E的结构简式为 _______。
(3)写出B-C的反应类型:_______。
(4)请写出同时满足下列条件的F的一种同分异构体的结构简式________。
①能发生银镜反应;②水解产物能与FeCl3显色:③核磁共振氢谱显示有四组峰。
(5)请写出以乙醇为原料制备强吸水性树脂 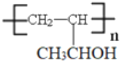 的合成路线流程图________(可选择题干中相关试剂,无机试剂任选,合成路线流程图示例见本题题干)。
的合成路线流程图________(可选择题干中相关试剂,无机试剂任选,合成路线流程图示例见本题题干)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、磷、硫等元素形成的单质和化合物在生活、生产中有重要的用途。
(1)下列氮原子的电子排布图表示的状态中,能量由低到高的顺序是____(填字母)。
A. ![]()
B. ![]()
C. ![]()
D. ![]()
(2)P4S3可用于制造火柴,其分子结构如图所示:
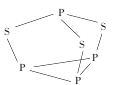
①P4S3分子中硫原子的杂化轨道类型为____。
②每个P4S3分子中含有的孤电子对的数目为____对。
(3)科学家合成了一种阳离子“N5n+”,其结构是对称的,5个N排成“V”形,每个N都达到8电子稳定结构,且含有2个氮氮三键,此后又合成了一种含有“N5n+”的化学式为“N8”的离子晶体(该晶体中每个N原子都达到了8电子稳定结构),N8的电子式为____。(CN)2中键与键之间的夹角为180°,并有对称性,分子中每个原子的最外层均满足8电子稳定结构,其结构式为____。
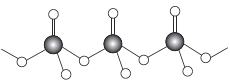
(4)直链多磷酸根阴离子是由两个或两个以上磷氧四面体通过共用顶角氧原子连接起来的,其结构如图所示。则由n个磷氧四面体形成的这类磷酸根离子的通式为____。
(5)碳酸盐中的阳离子不同,热分解温度就不同。下表为四种碳酸盐的热分解温度和对应金属阳离子的半径。随着金属阳离子半径的增大,碳酸盐的热分解温度逐渐升高,原因是 ___。
碳酸盐 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
热分解温度/℃ | 402 | 900 | 1172 | 1360 |
金属阳离子半径/pm | 66 | 99 | 112 | 135 |
(6)石墨的晶胞结构如图所示。已知石墨的密度为ρg.cm-3,C-C键的键长为r cm,M为阿伏加德罗常数的值,则石墨晶体的层间距d= ___cm。
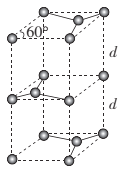
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价,如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是( )
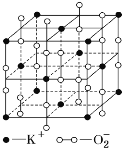
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个,晶体中与每个O2-距离最近的O2-有6个
D.晶体中其中0价氧和-2价氧的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在相应的条件下可能大量共存的是( )
A. 能使pH试纸变红的溶液中:CO32-、K+、Cl-、Na+
B. 由水电离产生的c(OH-)=1×10-10mol·L-1的溶液中:NO3-、Mg2+、Na+、SO42-
C. 在![]() =1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
=1×10-12的溶液中:NH4+、Fe2+、Cl-、NO3-
D. ![]() =10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
=10-10mol·L-1的溶液中:Na+、HCO3-、Cl-、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下有机物:① ![]() ②
② ![]() ③
③ ![]() ④
④ ![]() ⑤苯酚(填序号)
⑤苯酚(填序号)
(1)能与Na反应的是 ________ ;
(2)能与![]() 溶液反应的有_________;
溶液反应的有_________;
(3)能与NaHCO3溶液反应有气泡产生的是_______________;
(4)能与银氨溶液发生银镜反应的有____________________;
(5)既能发生消去反应,又能发生酯化反应的有___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列说法正确的是
A.0.l mol C2H6O 分子中含 C-H 键数目为 0.5 NA
B.1 mol·L-1 的 NH4Cl 溶液中含有![]() 数目小于 0.1 NA
数目小于 0.1 NA
C.25℃时,1 L pH=13 的 Ba(OH)2 溶液中含有 OH-的数目为 0.2NA
D.1 mol Cl2 与足量铜铁合金反应,转移电子数一定是 2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天门冬氨酸锌是一种补锌剂,可以![]() 、天门冬氨酸(
、天门冬氨酸(![]() )为原料制备。回答下列问题:
)为原料制备。回答下列问题:
(1)Zn成为阳离子时首先失去______轨道电子。碲(Te)与O同主族,则Te元素中电子占据的能量最高的能级是______。
(2)P是N的同族元素,PH3与NH3中稳定性更高的是______(填化学式),其判断理由是______;酞菁铜可用于生产蓝色颜料(结构如图),其中C原子的轨道杂化类型为______。
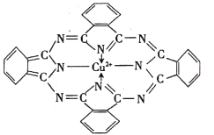
(3)CO为______(填“极性”或“非极性”)分子。
(4)ZnO晶体的一种晶胞结构如图:
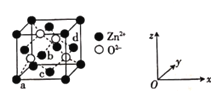
①![]() 的配位数为____________。
的配位数为____________。
②以晶胞边长为单位长度建立的坐标系可表示晶胞中锌原子的位置,称作原子分数坐标。图中原子a的分数坐标为![]() ,原子d的分数坐标为
,原子d的分数坐标为![]() ,则原子b和c的分数坐标分别为______、______。
,则原子b和c的分数坐标分别为______、______。
③设![]() 为阿伏加德罗常数的值。已知晶胞边长为
为阿伏加德罗常数的值。已知晶胞边长为![]() nm,则ZnO晶体的密度为______(列出计算式)
nm,则ZnO晶体的密度为______(列出计算式)![]() 。
。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com