
| 催化剂 |
| n(H2) |
| n(CO2) |
| n(H2) |
| n(CO2) |
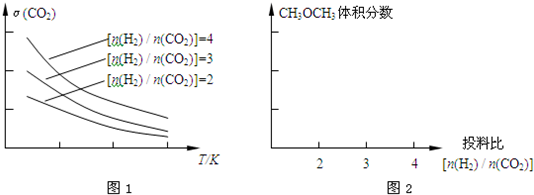
 CH4(g)+2H2O(g),
CH4(g)+2H2O(g), CH4(g)+2H2O(g)可以是②+③-①×2得到,
CH4(g)+2H2O(g)可以是②+③-①×2得到, CH4(g)+2H2O(g),△H=-162kJ?mol-1;
CH4(g)+2H2O(g),△H=-162kJ?mol-1; ,故答案为:
,故答案为: ;
;

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案科目:高中化学 来源: 题型:
| A、XY |
| B、XY2 |
| C、X2Y |
| D、X2Y3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 ,则其单体的结构简式为
,则其单体的结构简式为

查看答案和解析>>
科目:高中化学 来源: 题型:
 看,分子中含有碳碳双键,由此推测,苯能使酸性高锰酸钾溶液褪色且苯的6个碳原子之间的键有两种.
看,分子中含有碳碳双键,由此推测,苯能使酸性高锰酸钾溶液褪色且苯的6个碳原子之间的键有两种.查看答案和解析>>
科目:高中化学 来源: 题型:

| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ、碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g).
Ⅰ、碘钨灯具有使用寿命长、节能环保等优点.一定温度下,在碘钨灯灯泡内封存的少量碘与沉积在灯泡壁上的钨可以发生如下的可逆反应:W(s)+I2(g)?WI2(g).查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 酸 | 碱 | 盐 | |
| A | 硫 酸 | 纯 碱 | 食 盐 |
| B | 硝 酸 | 烧 碱 | 明 矾 |
| C | 醋 酸 | 氧化铜 | 小苏打 |
| D | 磷 酸 | 熟石灰 | 苛性钠 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com