
����Ŀ����֪��������ʵ��ܶȻ��������±���
���� | Cu(OH)2 | Fe(OH)3 | CuCl | CuI |
Ksp | 2.2��10-20 | 2.6��10-39 | 1.7��10-7 | 1.3��10-12 |
����ij����CuCl2��Һ�к���������FeCl2��Ϊ�õ�������CuCl2��2H2O����,����ͼ��������ᴿ��

��1�����ʺ���������X����_________������ĸ��������X��Ŀ����______________��
A��K2Cr2O7B��NaClO C��H2O2D��KMnO4
���������Y��____________���ѧʽ����������ҺpH��4��ʹ��Һ�е�Fe3��ת��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3��)��__________�����˺�������Һ����������Ũ���ᾧ���ɵõ�CuCl2��2H2O���塣
��2��ijѧϰС��������ӵ��������ⶨ����CuCl2��2H2O���������(��������I��������Ӧ������������)�Ĵ��ȣ��������£�ȡ0.36 g��������ˮ���������KI���壬��ַ�Ӧ�����ɰ�ɫ��������0.1000 mol��L-1Na2S2O3����Һ�ζ�������ζ��յ�ʱ������Na2S2O3����Һ20.00mL��(I2��2S2O32-= S4O62-��2I��)
�ٿ�ѡ��___________���ζ�ָʾ����
��CuCl2��Һ��KI��Ӧ�����ӷ���ʽΪ________________��
�۸�������CuCl2��2H2O�������ٷ���Ϊ_______________��
���𰸡�C ��Fe2��������Fe3�����������ɳ�����Cu2������ CuO��Cu(OH)2��CuCO3��Cu2(OH)2CO3������ 2.6��10��9mol��L��1 ���� 2Cu2����4I��=2CuI����I2 95%
��������
��1������������ʵ��ܶȻ�������Fe(OH)3���ܶȻ���С��Ϊ�˳�ȥCuCl2��Һ�к���������FeCl2����Ҫ��Fe2������ΪFe3�������ʺ���������X����H2O2��Ϊ�˵�����ҺpH��4���ֲ����������ʼ��������Y��CuO��Cu(OH)2��CuCO3��Cu2(OH)2CO3��ʹ��Һ�е�Fe3����ȫת��ΪFe(OH)3��������ʱ��Һ�е�c(Fe3��)�� mol��L��1��
mol��L��1��
��2���ٷ�Ӧ�������еⵥ�ʣ���ѡ�õ������ζ�ָʾ������CuCl2��Һ��KI��Ӧ���ɵⵥ�ʺ͵⻯��ͭ���������ӷ���ʽΪ2Cu2����4I��===2CuI����I2��
��
X=0.002mol����������CuCl2��2H2O�������ٷ���Ϊ![]() 95%
95%


 �߲������Ӧ��һ��ͨϵ�д�
�߲������Ӧ��һ��ͨϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ƽ�������ʾ�����������л���������ķϲ�����ĩ(��SiO2��Fe2O3��CeO2)�����÷ϲ�����ĩ������ȡ���ֻ�����Ʒ�������������:
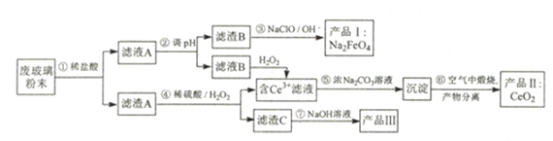
�������Ͽ�֪:
��CeO2����:���ƻ�ƺ�ɫ��ĩ��������ˮ�ͼ������;��ǿ�����ԡ�
��Ce3+�ڼ����̼������Һ���������ܵ�̼�Ḵ��Ce2(CO3):Na2CO3��2H2O��
�۳���ʱ���ֳ�������ܶȻ�����:
������ | Fe(OH)3 | Ce(OH)3 |
Ksp | 4.0��10-38 | 1.5��10-20 |
�ش���������:
(1)���̢ٷ���������õ��IJ���������_______________________________��
(2)���̢��з�����Ӧ�����ӷ���ʽΪ_________________________________�����̢��з����Ļ�ѧ��Ӧ����ʽΪ__________________________________��
(3)��ƷI��һ�����͡���ɫ�Ķ�ܾ�ˮ���������������������������������������������Ϊһ�塣��ˮ�����У�Na2FeO4 ���������������õ�ԭ����_________________��
(4)��ҵ��Ҳ���õ��ŨNaOH��Һ�Ʊ���ƷI���������缫��д�����ʱ���������ĵ缫��Ӧ����ʽ_________________��
(5)���������У���ij������Ũ�Ƚ���10��5 mol��L-1ʱ������Ϊ��������ȫ���������̢���Fe3+������ȫʱ��Һ��pH=_____ (��֪ lg2=0.3)��
(6)д����ƷIII��һ����;______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������[NH4Fe(SO4)2��xH2O]��һ����Ҫ���Ρ�Ϊ���������Դ�����Ϊ������ʵ������̽�����÷���м���Ʊ�������泥������������£�
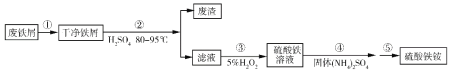
�ش��������⣺
��1������ٵ�Ŀ����ȥ������м��������ۣ�������_________________��
��2���������Ҫ���ȵ�Ŀ����_________________���¶ȱ���80~95 �棬���õĺ��ʼ��ȷ�ʽ��_________________����м�к������������Ӧ������������Ҫ�������������ʵ�װ��Ϊ_________________�����ţ���
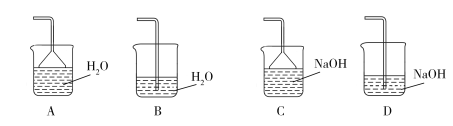
��3���������ѡ��������H2O2��������_________________����������H2O2��ͬʱΪ��_________________����ҺҪ����pHС��0.5��
��4������ݵľ���ʵ�������______________��������õ�������茶�����Ʒ��
��5���������ط������ⶨ������茶�����Ʒ�����ᾧˮ��������Ʒ���ȵ�150 ��ʱ��ʧ��1.5���ᾧˮ��ʧ��5.6%��������茶���Ļ�ѧʽΪ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Һ A�п��ܺ����������ӣ�Na+��NH4+��Ba2+��Mg2+��SO42����SO32����Cl����OH����ijͬѧ��Ʋ���������µ�ʵ�飺
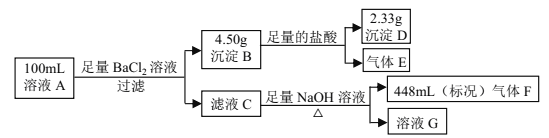
����˵����ȷ����
A. ��Һ A ��һ������ NH4+�� SO42���� SO32�������ܴ��� Na+
B. ��Һ A ��һ������ NH4+�� Mg2+�� SO42���� SO32�������ܴ��� Cl��
C. ��Һ A �п��ܴ��� Cl������ c(Na+) �� 0.20 mol��L-1
D. ������� F ��ʹʪ�����ɫʯ����ֽ��죬˵����Һ��һ������ NH4+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ����������ȼ�ϵ�ؿ�������ˮ��������ˮ�������乤��ԭ����ͼ��ʾ������˵����ȷ����

A. aΪ��ص�����
B. ��ˮ������ԭ���ǣ���ع���ʱ��Na+�������ң�C1-��������
C. ����NO�ĵ缫��ӦΪ��2 NO+6H2O+10e-===N2��+12OH-
D. ����C6H12O6��ʾ�л���ˮ���л��ÿ����1 mol C6H12O6ת��6 mol e-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��S-�տ��صķ��ӽṹ��ͼ�����й��ڸ����ʵ�˵����ȷ����
![]()
A.���л����ܷ���ȡ�����ӳɺ�ˮ�ⷴӦB.1mol���л����������巴Ӧ�������4mol Br2
C.���л���ķ���ʽΪC15H21O4D.1mol���л���������Na��Ӧ��������1mol H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����������˵������ȷ����(����)
A.��״���£�22.4 L����ͨ��1 Lˮ��ת�Ƶĵ�����ΪNA
B.��״���£�11.2 L SO3������ԭ����Ϊ2NA
C.1 mol FeCl3��ȫˮ��ת��Ϊ�������������������NA������
D.15.6 g Na2S��Na2O2�Ļ�����к��е�������������0.2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������������3mol A��1mol B�����������ڹ̶��ݻ�Ϊ2L���ܱ����������������·�Ӧ��3A(g) �� B(g) ![]() xC(g) �� 2D(g)��2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D�������C��Ũ��Ϊ0.2mol��L��1�������жϴ������
xC(g) �� 2D(g)��2minĩ�÷�Ӧ�ﵽƽ�⣬����0.8mol D�������C��Ũ��Ϊ0.2mol��L��1�������жϴ������
A. x��1
B. B��ת����Ϊ50%
C. 2min��A�ķ�Ӧ����Ϊ0.3mol��L��1��min��1
D. ����������ƽ����Է����������䣬������÷�Ӧ�ﵽƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ϡ��Ԫ�أ���Ƚ���������Ҫ��ս����Դ���ڹ�ҵ������Ҫ��Ӧ�ã��ҹ������Ļ�ѧ�������������ϡ��������ȡ���ۣ�����Ϊ���й�ϡ��֮������
��1����ɲ���ƽ���з�Ӧ�����ӷ���ʽ��______Ce3+______H2O2+______H2O��______Ce��OH��4��+____________��
��2������ԭ�Ӻ����______�������Dz㣬H2O �Ŀռ乹��Ϊ______��
��3������Ӧ���� 52g Ce��OH��4 ���ɣ���ת�Ƶ��ӵ���ĿΪ______��
��4��ʵ�����н�����ȡʵ��ʱ�������������ձ�֮�⣬����Ҫ�IJ�����������______��
��5��ȡ������Ӧ�õ��� Ce��OH��4 ��Ʒ 0.500g���������ܽ���� 0.100molL-1 FeSO4 ����Һ�ζ����յ�ʱ���汻��ԭΪ Ce3+�������� 20.00 mL ����Һ������Ʒ�� Ce��OH��4����������Ϊ______��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com