
 分类回收垃圾可以变废为宝.应扔进带有如图所示标志垃圾箱的是( )
分类回收垃圾可以变废为宝.应扔进带有如图所示标志垃圾箱的是( )| A、废旧报纸 | B、废旧电池 |
| C、铝制饮料罐 | D、废钢铁 |
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
| c(H+) |
| c(OH-) |
| c(H+) |
| c(H2C2O4) |
c(C2
| ||
c(HC2
|
c2(H+)?c(C2
| ||
| c(H2C2O4) |
查看答案和解析>>
科目:高中化学 来源: 题型:
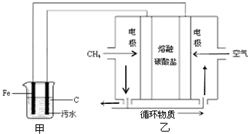 某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.该厂污水处理设计装置如图所示,下列说法正确的是( )
某污水中含有Fe3+、Ag+、Cu2+等离子,某工厂采用电解的方法处理该污水,具体的做法是:保持污水的pH在5.0~6.0之间,通过电解生成Fe(OH)3.Fe(OH)3具有吸附性,可吸附污物而沉积下来,有净化水的作用,阴极产生的气泡把污水中悬浮物带到水面形成浮渣层,刮去(或撇掉)浮渣层,即起到了浮选净化的作用.该厂污水处理设计装置如图所示,下列说法正确的是( )| A、为了增加污水的导电能力,可向污水中如入适量的Na2SO4固体 |
| B、甲装置中Fe电极的反应为Fe-3e-=Fe3+ |
| C、为了使该燃料电池长时间稳定运行,电池的电解质组成应保持稳定,电池工作时,循环物质为H2O |
| D、当乙装置中有1.6g CH4参加反应,则C电极理论上生成气体在标准状况下为8.96L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、44g二氧化碳含有的原子总数为3NA |
| B、1L1mol/L的氯化钠溶液中,所含离子总数为NA |
| C、标准状况下,11.2L水所含分子数为0.5 NA |
| D、在反应中,1mol镁转化为Mg2+后失去的电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过氧化钠与水反应,每产生标准状况下11.2 L O2,转移NA个电子 | ||
| B、含NA个氧原子的氧气在标准状况下的体积约为22.4 L | ||
C、1 个氢气分子的实际质量约为
| ||
| D、1 mol Na 原子中约含有NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下11.2 L氯气 |
| B、17g氨气 |
| C、0.8mol氧气 |
| D、4℃时,36mL的H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、煤经过气化和液化等物理变化,可变为清洁能源 |
| B、服用铬含量超标的药用胶囊会对人体健康造成危害 |
| C、竹炭具有超强的吸附能力,能吸附新装修房屋内的有害气体 |
| D、采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 实验步骤 | 实验操作 | 实验现象和结论 |
| 步骤一 | ||
| 步骤二 | ||
| 步骤三 | ||
| … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com