
| A. | 通入HCl | B. | 加NaX | C. | 加热 | D. | 加镁粉 |
分析 加水稀释或加入能和氢离子反应的物质能促进弱酸电离且溶液中氢离子浓度减小,据此分析.
解答 解:A.向溶液中加入HCl,氢离子浓度增大,平衡向逆反应方向移动,酸的电离程度减小,故A错误;
B.向溶液中加入NaX,酸根离子浓度增大,抑制酸电离,酸的电离程度较小,氢离子浓度减小,故B错误;
C.加热促进弱酸的电离,溶液中氢离子浓度增大,故C错误;
D.向溶液中加入Mg,Mg与氢离子反应氢离子浓度减小,电离平衡向正方向移动,电离程度增大,故D正确;
故选D.
点评 本题考查了影响弱电解质电离的因素,难度不大,注意:如果加入含有相同离子的物质就抑制其电离,如果加入和弱电解质电离的离子发生反应的物质就促进其电离.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:选择题
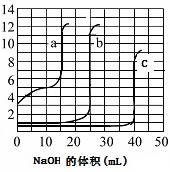
| A. | 由图可知曲线c为NaOH滴定盐酸 | |
| B. | 由图可知曲线a为NaOH滴定盐酸 | |
| C. | 滴定实验可用紫色石蕊试液做指示剂 | |
| D. | 由图可知曲线b为NaOH滴定盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+ | B. | Cl- | C. | Ag+ | D. | NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 如图所示电解装置的电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.通电时发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.
如图所示电解装置的电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开.通电时发现右侧溶液变蓝色,一段时间后,蓝色逐渐变浅.已知:3I2+6OH-═IO3-+5I-+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解时,产生具有吸附性的胶体粒子,可做净水剂 | |
| B. | 用氢氧化铝、碳酸氢钠或烧碱治疗胃酸过多 | |
| C. | 二氧化硫是无色气体,有强烈刺激性气味,是大气主要污染物之一,可以用作食物和干果的防腐剂 | |
| D. | 氯气制备消毒液或漂白粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com