
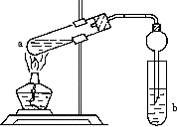
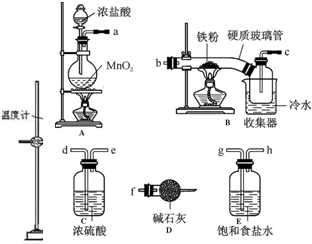
 如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.
如图,在试管a中先加入2mL95%的乙醇,再加入3mL无水醋酸,边摇边缓缓加入2mL浓H2SO4,用玻璃棒充分搅拌后将试管固定在铁架台上,在试管b中加入7mL饱和碳酸钠溶液.连接好装置.用酒精灯对试管a加热,当观察到试管b中有明显现象时停止实验.分析 (1)乙酸与乙醇发生酯化反应生成乙酸乙酯和水;
(2)酯化反应中,浓硫酸起到了催化剂和吸水剂的作用;
(3)乙醇和乙酸易溶于水,容易发生倒吸现象,用球形管可以起到防止倒吸的作用;
(4)乙酸乙酯在饱和碳酸钠溶液容易中的溶解度较小,且能够溶解乙醇、中和乙酸;
(5)酯化反应的本质为酸脱羟基,醇脱氢,乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,该反应为可逆反应.依据有机酯化反应的本质“酸脱羟基醇脱氢”.
解答 解:(1)乙醇与乙酸发生酯化反应的方程式为:CH3COOH+HOC2H5$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,故答案为:CH3COOH+HOC2H5$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)酯化反应为可逆反应,用浓硫酸吸水有利于乙酸乙酯的生成,另外浓硫酸还起到了催化剂的作用,
故答案为:催化剂、吸水剂;
(3)由于乙酸乙酯中混有的乙醇、乙酸易溶于水,易发生倒吸现象,所以该实验装置中使用球形管除起冷凝作用外,还可以起到防止倒吸的作用,
故答案为:防止发生倒吸;
(4)碳酸钠能够中和乙酸、溶解乙醇,且乙酸乙酯在饱和碳酸钠溶液容易中的溶解度减小,所以试管乙中饱和碳酸钠的作用是中和乙酸、溶解乙醇,减小酯在水中的溶解度,
故答案为:吸收乙酸;溶解乙醇;降低乙酸乙酯在水中的溶解度,利于分层观察;
(5)将1mol乙醇(其中的氧用18O标记)在浓硫酸存在条件下与足量乙酸充分反应,化学方程式为:CH3COOH+H18OCH2CH3$?_{△}^{浓硫酸}$CH3CO18OCH2CH3+H2O,乙酸乙酯的摩尔质量为88g/mol,1mol乙醇应反应生成1mol乙酸乙酯,但反应是可逆反应,乙酸和乙醇挥发,所以不能进行彻底,应小于90g,可能生成44g乙酸乙酯,只有B错误.
故答案为:B.
点评 本题考查了制备方案的设计,题目难度不大,明确酯化反应原理为解答关键,注意掌握酯化反应中浓硫酸、饱和碳酸钠溶液溶液的作用,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源:2016-2017学年云南省高一9月月考化学卷(解析版) 题型:选择题
下列叙述正确的是
A.固体氯化钠不导电,所以氯化钠是非电解质 B.铜丝能导电,所以铜是电解质
C.氯化氢水溶液能导电,所以氯化氢是电解质 D.SO3溶于水能导电,所以SO3是电解质
查看答案和解析>>
科目:高中化学 来源:2016-2017学年安徽师大附中高二上10月月考化学卷(解析版) 题型:选择题
一定条件下溶液的酸碱性对TiO2光催化燃料R降解反应的影响如图所示。下列判断正确的是
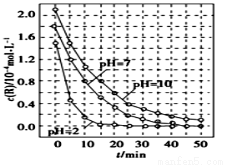
A.溶液酸性越强,R 的降解速 率越小
率越小
B.R的起始浓度越小,降解速率越大[
C.在0~50 min之间,pH=2和PH=7时R的降解百分率相等
D.在20~25 min之间,pH=10 时R的平均降解速率为0.04 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
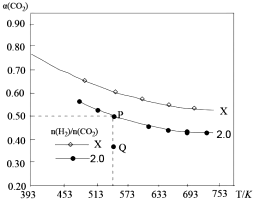 在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )
在两个固定容积均为1L密闭容器中以不同的氢碳比[n(H2):n(CO2)]充入H2和CO2,在一定条件下发生反应:2CO2(g)+6H2 (g)?C2H4(g)+4H2O(g)△H.CO2的平衡转化率a(CO2)与温度的关系如图所示.下列说法正确的是( )| A. | 该反应在高温下自发进行 | |
| B. | 氢碳比:X<2.0 | |
| C. | 氢碳比为2.0时.Q点v(H2)逆小于P点的v(H2)逆 | |
| D. | 向处于P点状态的容器中,按2:4:1:4的比例再充入CO2、H2、C2H4•H2O,再次平衡后a(CO2)减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
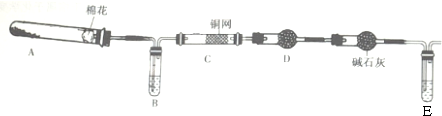
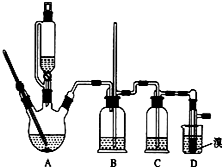 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
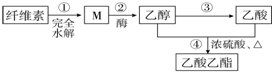
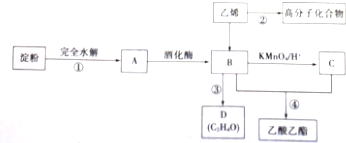
| A. | ③和④都发生了氧化还原反应 | |
| B. | M虽然分子结构中无醛基,但仍然可以发生银镜反应 | |
| C. | 步骤②,1molM完全反应可以生成3mol乙醇 | |
| D. | 若用淀粉替代纤维素,一定条件下也能按照此路线制备乙酸乙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com