
一定条件下,在体积为3 L的密闭容器中反应CO(g)+2H2(g)  CH3OH(g) ΔH=a kJ·mol-1,ΔS=b J·mol-1·K-1(a、b均为正数),达到化学平衡状态。
CH3OH(g) ΔH=a kJ·mol-1,ΔS=b J·mol-1·K-1(a、b均为正数),达到化学平衡状态。
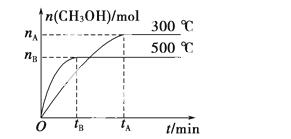
(1)500 ℃时,从反应开始到达到化学平衡,以H2的浓度变化表示的化学反应速率是__________(用nB、tB表示)。
(2)判断该可逆反应达到化学平衡状态的标志是________(填字母)。
a.v生成(CH3OH)=v消耗(CO)
b.混合气体的密度不再改变
c.混合气体的平均相对分子质量不再改变
d.CO、H2、CH3OH的浓度均不再变化
(3)300 ℃时,将容器的容积压缩到原来的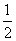 ,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
,在其他条件不变的情况下,对平衡体系产生的影响是________(填字母)。
a.c(H2)减小
b.正反应速率加快,逆反应速率减慢
c.CH3OH的物质的量增加
d.重新平衡时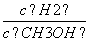 减小
减小
 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
下列说法中正确的是
A.分子中键能越大,键长越长,则分子越稳定
B.P4和CH4都是正四面体分子且键角都为109o28ˊ
C.在化学反应中,某元素由化合态变为游离态,该元素被还原
D.电子层结构相同的不同离子,其半径随核电荷数增多而减小
查看答案和解析>>
科目:高中化学 来源: 题型:
有甲、乙两容器,甲容器容积固定,乙容器容积可变。一定温度下,在甲中加入2 mol N2、3 mol H2,反应N2(g)+3H2(g) 2NH3(g)达到平衡时生成NH3的物质的量为m mol。
2NH3(g)达到平衡时生成NH3的物质的量为m mol。
(1)相同温度下,在乙中加入4 mol N2、6 mol H2,若乙的压强始终与甲的压强相等,乙中反应达到平衡时,生成NH3的物质的量为________ mol(从下列各项中选择,只填序号,下同);若乙的容积与甲的容积始终相等,乙中反应达到平衡时,生成NH3的物质的量为________mol。
A.小于m B.等于 m
C.在m~2m之间 D.等于2m
E.大于2m
(2)相同温度下,保持乙的容积为甲的一半,并加入1 mol NH3,要使乙中反应达到平衡时,各物质的体积分数与上述甲容器中达到平衡时相同,则起始时应加入________mol N2和________ mol H2。
查看答案和解析>>
科目:高中化学 来源: 题型:
在可逆反应2SO2+O2 2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商) ( )。
2SO3的平衡状态下,保持恒温恒容向容器中加入一定量的O2,下列说法正确的是(K为平衡常数,Qc为浓度商) ( )。
A.Qc不变,K变大,O2转化率增大
B.Qc不变,K变大,SO2转化率增大
C.Qc变小,K不变,O2转化率减小
D.Qc增大,K不变,SO2转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是 ( )。

A.①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B.②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C.③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D.④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式硫酸铁Fe(OH)SO4对水中的悬浮物、有机物、硫化物、重金属等都能絮凝,工业上常用硫酸亚铁法制备,工艺流程如下图所示:
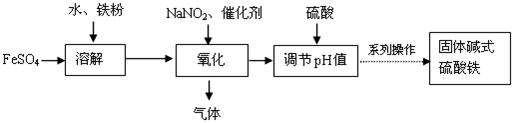
已知: Fe3+沉淀完全时的pH=3.1, Fe2+沉淀完全时的pH=9.7。
(1)请写出溶解过程中加快溶解速率和提高浸出率的两点措施:
_______________________________,______________________________。
(2)加入硫酸的作用是控制体系的pH值,若硫酸加入量过小,反应体系酸度太低,容易生成 沉淀;若硫酸加入量过大,不利于产品形成,试从平衡移动的角度分析原因是 。
(3)氧化过程中生成的气体遇空气变红棕色。写出氧化过程发生的离子方程式:
________________________________________________________________。
(4)流程图中的“系列操作”包括 , ,过滤,洗涤,烘干。
查看答案和解析>>
科目:高中化学 来源: 题型:
工业上可用CO2生产甲醇,反应为CO2(g)+3H2(g)  CH3OH(g)+H2O(g)。将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图7-2实线所示。图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化。下列说法正确的是( )
CH3OH(g)+H2O(g)。将6 mol CO2和8 mol H2充入2 L的密闭容器中,测得H2的物质的量随时间变化如图7-2实线所示。图中虚线表示仅改变某一反应条件时,H2物质的量随时间的变化。下列说法正确的是( )
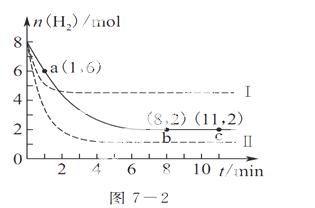
A.曲线Ⅱ对应的条件改变是降低压强
B.若曲线Ⅰ对应的条件改变是升高温度,则该反应ΔH>0
C.反应开始至a点时v(H2)=1 mol·L-1·min-1
D.其他条件不变,若降低该反应的温度,平衡常数值将减小
查看答案和解析>>
科目:高中化学 来源: 题型:
随着汽车数量的逐年增多,汽车尾气污染已成为突出的环境问题之一。反应:2NO(g)+2CO(g)  2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
2CO2(g)+N2(g)可用于净化汽车尾气,已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是( )
A.提高尾气净化效率的最佳途径是研制高效催化剂
B.提高尾气净化效率的常用方法是升高温度
C.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
D.570 K时及时抽走CO2、N2,平衡常数将会增大,尾气净化效率更佳
查看答案和解析>>
科目:高中化学 来源: 题型:
用已知浓度的NaOH溶液测定某H2SO4溶液的浓度,
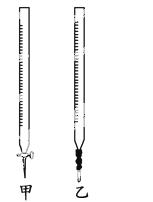 如右图甲、乙,从下表中 选出正确选项 ( )
如右图甲、乙,从下表中 选出正确选项 ( )
| 锥形瓶 中溶液 | 滴定管中溶液 | 选用指 示剂 | 选用滴定管 | |
| A | 碱 | 酸 | 石蕊 | 甲 |
| B | 酸 | 碱 | 酚酞 | 甲 |
| C | 碱 | 酸 | 甲基橙 | 甲 |
| D | 酸 | 碱 | 酚酞 | 乙 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com