
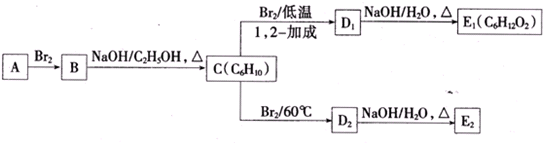
 .
.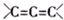 为不稳定结构.
为不稳定结构. .
. .
. 分析 烃A的相对分子质量为84,则$\frac{84}{14}$=6,由于分子中含有碳碳双键,则A应为烯烃,分子中只有一种类型的氢,则烃A为对称结构,即双键碳原子上的4个H均被甲基取代,A的结构简式为 ,则B为
,则B为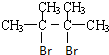 ,在氢氧化钠、乙醇溶液中加热时发生消去反应,生成的C为
,在氢氧化钠、乙醇溶液中加热时发生消去反应,生成的C为 ,C发生1,2-加成生成D1,则D1为
,C发生1,2-加成生成D1,则D1为 ,D1在氢氧化钠水溶液中发生水解反应生成E1,则E1为
,D1在氢氧化钠水溶液中发生水解反应生成E1,则E1为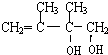 ,D1、D2互为同分异构体,故生成D2的反应④为1,4-加成,则D2为
,D1、D2互为同分异构体,故生成D2的反应④为1,4-加成,则D2为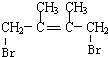 ,D2在氢氧化钠水溶液中发生水解反应生成E2,E2为
,D2在氢氧化钠水溶液中发生水解反应生成E2,E2为 ,据此解答.
,据此解答.
解答 解:烃A的相对分子质量为84,则$\frac{84}{14}$=6,由于分子中含有碳碳双键,则A应为烯烃,分子中只有一种类型的氢,则烃A为对称结构,即双键碳原子上的4个H均被甲基取代,A的结构简式为 ,则B为
,则B为 ,在氢氧化钠、乙醇溶液中加热时发生消去反应,生成的C为
,在氢氧化钠、乙醇溶液中加热时发生消去反应,生成的C为 ,C发生1,2-加成生成D1,则D1为
,C发生1,2-加成生成D1,则D1为 ,D1在氢氧化钠水溶液中发生水解反应生成E1,则E1为
,D1在氢氧化钠水溶液中发生水解反应生成E1,则E1为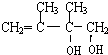 ,D1、D2互为同分异构体,故生成D2的反应④为1,4-加成,则D2为
,D1、D2互为同分异构体,故生成D2的反应④为1,4-加成,则D2为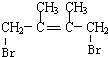 ,D2在氢氧化钠水溶液中发生水解反应生成E2,E2为
,D2在氢氧化钠水溶液中发生水解反应生成E2,E2为 .
.
(1)①测出相对分子质量,需用质谱仪;②测出官能团碳碳双键,需用红外光谱仪,故答案为:b;c;
(2)根据上述信息判断A的结构简式为 ,故答案为:
,故答案为: ;
;
(3)①B→C的化学反应方程式为: ,
,
故答案为: ;
;
②C为 ,化学名称为:2,3-二甲基-1,3-丁二烯;由上述分析可知,E2的结构简式是
,化学名称为:2,3-二甲基-1,3-丁二烯;由上述分析可知,E2的结构简式是 ;
;
故答案为:2,3-二甲基-1,3-丁二烯; .
.
点评 本题考查有机物推断,涉及卤代烃、烯等的性质与转化,关键是确定A的结构简式,再结合反应条件进行推断,注意二烯烃的加成反应,难度中等.


科目:高中化学 来源: 题型:解答题

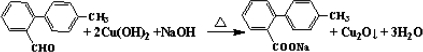 .
. 与
与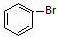 也可以发生类似反应①的反应,有机产物的结构简式为:
也可以发生类似反应①的反应,有机产物的结构简式为: .
.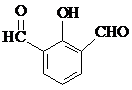 、
、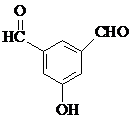 、
、
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碱金属单质的密度随着原子序数的增大而增大 | |
| B. | 碱金属单质都是银白色金属 | |
| C. | 在周期表中金属与非金属的分界处,可以找到半导体材料 | |
| D. | 所有气体单质都含有非极性键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;Z的电子式是
;Z的电子式是 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L三氯甲烷所含的分子数为0.5NA | |
| B. | 26g乙炔所含共用电子对数目为3NA | |
| C. | 常温常压下,11.2L一氯甲烷所含的分子数小于0.5NA | |
| D. | 现有乙烯、丙烯混合气体共28g,其原子数目小于6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制氯化铁溶液时,先将氯化铁溶于较浓盐酸,再用蒸馏水稀释并加入少量铁粉 | |
| B. | 试管里加入少量淀粉,再加入一定量稀硫酸,加热3~4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现 | |
| C. | 氢氧化钠沾到皮肤上,先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗 | |
| D. | 为了减少实验误差,中和滴定用的锥形瓶必须洗净并烘干后使用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 气体 | N2 | O2 | Ar | CO2 |
| 沸点 | -196℃ | -183℃ | -186℃ | -78℃ |
| A. | O2 | B. | N2 | C. | Ar | D. | CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 只含4个碳原子的烃中,碳原子间的相互结合方式共有如图所示七种情况 | |
| B. | 以上七种物质均属于烷烃 | |
| C. | c和f分子的空间构型相同 | |
| D. | d与g互为同分异构体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com