
| A. | 等于(a-0.8 )g | B. | 大于(a-0.8 )g | C. | 大于(a-2.67)g | D. | 等于(a-2.67)g |
分析 滴入50mL 2mol/L的盐酸时混合物恰好完全溶解,HCl中氢元素恰好与混合物中氧元素反应生成水,利用质量守恒可计算出混合物中含有氧元素的质量,从而得出氧化铁的质量,根据总质量可计算出混合物中铜的质量.
解答 解:50mL 2mol/L的盐酸中含有HCl的物质的量为:2mol/L×0.05L=0.1mol,
至50mL时混合物恰好完全溶解,说明混合物完全反应,氧化铁中氧元素恰好与HCl中的H完全反应转化成水,
则氧化铁中含有氧元素的物质的量为:$\frac{0.1mol}{2}$=0.05mol,则氧化铁的物质的量为:0.05mol×$\frac{1}{3}$,质量为:160g/mol×0.05mol×$\frac{1}{3}$≈2.67g,
所以混合物中铜的质量为:ag-2.67g,
若将a g该混合物在CO气流中加热并充分反应,冷却后剩余固体中铜的质量为:(a-2.67)g,
故选D.
点评 本题考查了混合物反应的计算,题目难度中等,明确HCl中的氢元素恰好与氧化铁中氧元素完全反应为解答关键,注意掌握质量守恒定律在化学计算中的应用方法.


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 构成原电池正极和负极的材料必须是两种活泼性不同的金属 | |
| B. | 由铜、锌作电极与硫酸铜溶液组成的原电池中铜是负极 | |
| C. | 电子沿外导线由锌流向铜,内电路中电子通过稀硫酸被H+得到而放出氢气 | |
| D. | 铜锌原电池工作时,若有13 g锌被溶解,电路中就有0.4 mol电子通过 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CF4、CCl4、CBr4、CI4的熔点沸点升高与范德华力有关 | |
| B. | H2O的熔、沸点大于H2S的是由于H2O之间存在氢键 | |
| C. | 乙醇与水互溶可以用相似相溶原理解释 | |
| D. | 分子晶体中分子一定紧密堆积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2L 二氧化硫气体中含有0.5NA个SO2分子 | |
| B. | 常温下,3.2g硫与足量铁粉充分反应,转移的电子数为0.2 NA个 | |
| C. | 1 mol 苯分子中含有3 NA个碳碳双键 | |
| D. | 0.1mol•L-1的Na2S溶液中含有0.2NA个Na+离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.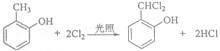 .
. .
. 既可发生酯化反应生成香豆素,可发生加聚反应.该物质加聚产物的结构简式为
既可发生酯化反应生成香豆素,可发生加聚反应.该物质加聚产物的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
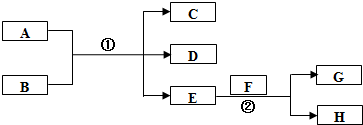
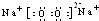 ;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.
;在反应②中,当生成2.24L的G(标准状况)时,反应转移的电子数目为0.2NA或1.024×1023.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 溶液 | CH3COONa | Na2CO3 | Na2CO3 | HClO | C6H5ONa |
| PH | 8.8 | 9.7 | 11.6 | 10.3 | 11.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com