
次磷酸钠(NaH2PO2)可用于化学镀镍。
(1)化学镀镍的溶液中含有Ni2+ 和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 mol。
(4)从二个反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:
碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应方程式:
①钠与过氧化钠反应
②钾还原硝酸钾,同时还产生了一种单质气体
【知识点】氧化还原反应的分析、化学反应方程式书写
【答案解析】(1) Ni2+ + H2PO2-+ 1H2O → Ni +1H2PO3-+ 2 H+(2分)
(2) H2PO2-(1分),Ni(1分)
(3) 2mol(2分)
(4) 3(2分)
(6)①Na2O2+2Na=2Na2O;②2KNO3+10K=6K2O+N2(各2分)
解析:(1)根据氧化还原反应中,化合价升降相等即可配平,(2) 根据失电子的物质是还原剂,反应式①中还原剂是H2PO2-,Ni化合价从 +2变为0,化合价降低,被还原。(3) H2PO2-中P的化合价为+1, H2PO3-中P的化合价为+3,反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 2mol。(4) 根据①生成1mol Ni有1mol H2PO3-生成,根据②生成1mol P有2mol H2PO3-生成,所以生成1mol Ni和1mol P,同时有3mol H2PO3-生成。(5)根据信息:要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐,即可写出钠与过氧化钠反应,钾还原硝酸钾的化学反应方程式。
【思路点拨】本题考查氧化还原反应的分析、化学反应方程式书写,关键理解氧化还原反应中,化合价升降相等,依据这一特征即可配平方程式。


科目:高中化学 来源: 题型:
下列离子方程式不正确的是 ( )
A.向FeBr2溶液中通入足量氯气:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
B.在亚硫酸中加入过量的次氯酸钠溶液:H2SO3+ClO-=Cl-+2H++SO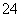
C.在碳酸氢镁溶液中加入过量氢氧化钠溶液:
Mg2++2HCO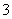 +4OH-=Mg(OH)2 ↓+2CO
+4OH-=Mg(OH)2 ↓+2CO +2H2O
+2H2O
D.在过氧化钠中加入稀硫酸:2Na2O2+4H+=4Na++2H2O+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
次磷酸钠(NaH2PO2)可用于化学镀镍。
(1)化学镀镍的溶液中含有Ni2+ 和H2PO2-,在酸性条件下发生以下镀镍反应:
① Ni2+ + H2PO2-+ → Ni + H2PO3-+
② 6H2PO2- +2H+ →2P+4H2PO3-+3H2↑
请配平反应式①。
(2)反应式①中还原剂是 ,被还原元素是 。
(3)反应②中,若生成1 mol H2PO3-,反应中转移电子的物质的量为 mol。
(4)从二个反应分析,若生成1mol Ni和1mol P,同时有 mol H2PO3-生成。
(5)完成下列各小题中的化学反应方程式:
碱金属与O2反应生成氧化物较复杂,有普通氧化物(如K2O)过氧化物(如K2O2)还有超氧化物和臭氧化物等。要制备碱金属的普通氧化物一般是用碱金属还原对应的过氧化物、硝酸盐或亚硝酸盐。写出下列化学反应方程式:
①钠与过氧化钠反应
②钾还原硝酸钾,同时还产生了一种单质气体
查看答案和解析>>
科目:高中化学 来源: 题型:
为了防止枪支生锈,常将枪支的钢铁零件放在NaNO2和NaOH的混合液中进行化学处理使钢铁零件表面生成Fe3O4的致密的保护层——“发蓝”。其过程可用下列化学方程式表示: ① 3Fe+NaNO2+5NaOH=3Na2FeO2+H2O+NH3↑
② Na2FeO2+ NaNO2+ H2O → Na2Fe2O4+ NH3↑+ NaOH
③ Na2FeO2+Na2Fe2O4+2H2O Fe3O4+4NaOH
Fe3O4+4NaOH
(1)配平化学方程式②。
(2)上述反应①中还原剂为 ,若有1mol Na2FeO2生成,则反应中有 mol电子转移。
(3)关于形成“发蓝”的过程,下列说法正确的是 。
A.该生产过程不会产生污染 B.反应③生成的四氧化三铁具有抗腐蚀作用
C.反应①②③均是氧化还原反应 D.反应①②中的氧化剂均为NaNO2
(4)当NaOH溶液浓度过大,“发蓝”的厚度会变小,其原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氢能源是一种重要的清洁能源。现有两种可产生
H2的化合物甲和乙。将6.00g甲加热至完全分解,只得到一种短周期元素的金属单质和6.72L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25g·L-1。请回答下列问题:
(1)甲与水反应的化学方程式是___________________________________。
(2)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式
_______________________________________________________。
有人提出生成的产物Cu中可能还混有Cu2O,请设计实验方案验证之。
(已知:Cu2O+2H+=Cu+Cu2++H2O)
_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是( )
A.铁跟稀H2SO4反应Fe+6H+===2Fe3++H2↑
B.向氯化亚铁溶液中通入氯气Fe2++Cl2===Fe3++2Cl-
C.向氯化铁溶液中加入适量铁粉Fe3++Fe===Fe2+
D.氯化铁溶液跟过量NaOH溶液反应Fe3++3OH-===Fe(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
下列能用勒·夏特列原理解释的是( )
A.高温及加入催化剂都能使合成氨的反应速率加快
B.红棕色的NO2加压后颜色先变深后变浅
C.SO2催化氧化成SO3的反应,往往需要使用催化剂
D.H2、I2、HI平衡时的混合气体加压后颜色变深
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com