
下述实验设计能够达到目的的是 ( )。
| 选项 | 实验目的 | 实验设计 |
| A | 除去CO2中少量的SO2 | 将混合气体通过饱和Na2CO3溶液 |
| B | 除去Cu粉中混有的CuO | 向混合物中滴加适量稀硝酸 |
| C | 检验溶液中是否含有Fe2+ | 向溶液中滴入氯水后,再滴加KSCN溶液 |
| D | 证明H2CO3酸性比H2SiO3强 | 将CO2通入Na2SiO3溶液中 |
科目:高中化学 来源: 题型:
过去电子工业常用30%的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板,发生反应的化学方程式为:
2FeCl3+Cu===2FeCl2+CuCl2。
(1)检验腐蚀后的溶液中是否含有Fe3+应选用的试剂是____________。
(2)采用下列实验步骤从使用过的腐蚀废液中回收铜,并重新制得纯净的FeCl3溶液,请在各空格内填上适当的分子式或化学式以使实验达到预期目的。
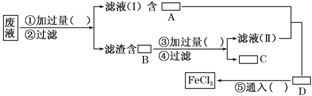
(3)写出有关化学反应的离子方程式_______________________________________,
__________________________________________________,
__________________________________________________,
__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
pH=2的两种一元酸x和y,体积均为100 mL,稀释过程中pH与溶液体积的关系如右图所示。分别滴加NaOH溶液(c=0.1 mol·L-1)至pH=7,消耗NaOH溶液的体积为Vx、Vy,则( )
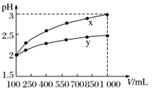
A.x为弱酸,Vx<Vy B.x为强酸,Vx>Vy
C.y为弱酸,Vx<Vy D.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
肯定属于同族元素且性质相似的是 ( )。
A.原子核外电子排布式:A为1s22s2,B为1s2
B.结构示意图:A为 ,B为
,B为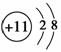
C.A原子基态时2p轨道上有1个未成对电子,B原子基态时3p轨道上也有1个未成对电子
D.A原子基态时2p轨道上有一对成对电子,B原子基态时3p轨道上也有一对成对电子
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了钠与氯气反应的装置,如下图所示。将一根玻璃管与氯气发生器相连,玻璃管内放一块黄豆粒大的金属钠(已吸净煤油),玻璃管尾部塞一团浸有NaOH溶液的棉花球。先给钠预热,直到钠熔融成圆球时,停止加热,通入氯气,即可见钠燃烧起来,产生大量白烟。下面的有关叙述错误的是( )
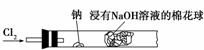
A.钠燃烧产生苍白色火焰
B.浸有NaOH溶液的棉花球是用于吸收过量的氯气,以避免污染空气
C.反应产生的大量白烟是氯化钠晶体
D.若在棉花球外沿滴一滴淀粉碘化钾溶液,可以判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
下列仪器:①普通漏斗;②容量瓶;③蒸馏烧瓶;④天平;⑤分液漏斗;⑥滴定管;⑦燃烧匙。常用于物质分离的是 ( )。
A.①③④ B.①②⑥
C.①③⑤ D.③④⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
下面是实验室制取少量固体氧化铜的实验,根据实验步骤,回答有关问题。
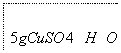 —→
—→ —→
—→
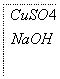 —→
—→ —→
—→
 —→
—→ —→
—→
(1)调整天平零点时,若指针偏向左边,应将左边的螺丝________(填“向左”或“向右”)旋动。
(2)溶解样品时要用到玻璃棒,其作用是_ ________________________________ ___________________________________________________________________。
(3)反应生成沉淀的离子方程式为______________________________________ ______________________________________________________________。
(4)加热蒸发过程中要用到玻璃棒,其作用是_ __________________________________ _________________________________________________________________。
(5)过滤中要用到玻璃棒,其作用是_________________________ _________________________。
(6)洗涤沉淀的目的是
__________________________________________________;
洗涤沉淀的方法是
__________________________________________________;
为了检验沉淀是否洗涤干净,应在最后一次的洗涤液中加入________溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是____________,属于化合反应的是____________,属于分解反应的是________________________,属于置换反应的是______________,属于复分解反应的是______________。
①Cu2S+O2 2Cu+SO2
2Cu+SO2
②3O2 2O3
2O3
③Fe2O3+3CO===2Fe+3CO2
④2Na+2H2O===2NaOH+H2↑
⑤CaCO3 CaO+CO2↑
CaO+CO2↑
⑥2H2O2===2H2O+O2↑
⑦SO3+H2O===H2SO4
⑧2Fe+3Cl2 2FeCl3
2FeCl3
⑨H2SO4+2NaOH===Na2SO4+2H2O
⑩NaH+H2O===NaOH+H2↑
⑪IBr+H2O===HIO+HBr
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答下列问题:
(1)用软锰矿制备K2MnO4的化学方程式是_______________________________________。
(2)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为__________________。生成0.1 mol还原产物时转移电子__________个。KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是__________________________________。
(3)KMnO4能与热的Na2C2O4(aq,硫酸酸化)反应生成Mn2+和CO2。若取用软锰矿制得的KMnO4产品 0.165 g,能与0.335 g Na2C2O4恰好完全反应(假设杂质均不能参与反应),该产品中KMnO4的纯度为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com