
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
 ,故答案为:
,故答案为: ;
; ,
, ;
;

 桃李文化快乐暑假武汉出版社系列答案
桃李文化快乐暑假武汉出版社系列答案 优秀生快乐假期每一天全新寒假作业本系列答案
优秀生快乐假期每一天全新寒假作业本系列答案 暑假接力赛新疆青少年出版社系列答案
暑假接力赛新疆青少年出版社系列答案科目:高中化学 来源: 题型:
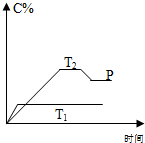 在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:
在一定条件下,可逆反应A+B?mC变化如图所示.已知纵坐标表示在不同温度和压强下生成物C在混合物中的质量分数,P为反应在T2温度时达到平衡后向容器加压的变化情况,问:查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| Q | Q的气态氢化物是一种10电子微粒,呈现碱性 |
| R | R是地壳中含量最丰富的元素 |
| X | X与Y在同一周期,X是这一周期中原子半径最大的元素 |
| Y | Y的次外层电子数是最外层电子数的两倍 |
| Z | Z是一种副族的金属元素,原子序数为26 |
查看答案和解析>>
科目:高中化学 来源: 题型:
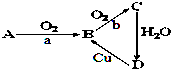 如图为A、B、C、D四种物质的转化关系,a、b为反应条件,
如图为A、B、C、D四种物质的转化关系,a、b为反应条件,查看答案和解析>>
科目:高中化学 来源: 题型:
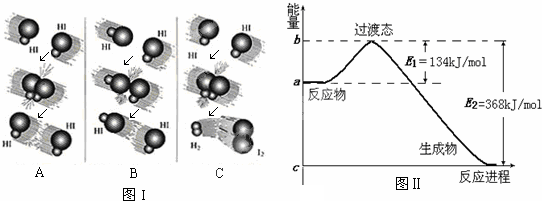
查看答案和解析>>
科目:高中化学 来源: 题型:
| 物质 | 杂质 | 除杂质的方法 | |
| A | CaCl2溶液 | HCl | 过量CaCO3、过滤 |
| B | NaOH溶液 | Ca(OH)2 | 过量Na2CO3溶液、过滤 |
| C | FeCl2溶液 | CuCl2 | 过量铁粉、过滤 |
| D | CO2 | H2O | 通过盛浓硫酸的洗气瓶 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com