
����Ŀ��������M���C�����������ͼ������ԭ���á������ܶȸߵ��ŵ㣬������Ϊ����Դ�������ƶ��豸�ĵ�Դ�������طŵ���ܷ�Ӧ����ʽΪ��4M+nO2+2nH2O=4M��OH�� n����֪����ص������۱�������ָ��λ�����ĵ缫�������������ͷų��������ܡ�����˵������ȷ������ ��

A�����ö�缫��Ŀ������ߵ缫��������Һ�ĽӴ��������������������ɢ���缫����
B���Ƚ�Mg��Al��Zn���ֽ����C������أ�Al�C������ص����۱��������
C����M�C��������У�Ϊ��ֹ����������Mg��OH��2���˲������Ե���ʼ������ӽ���Ĥ
D��M�C������طŵ���̵�������Ӧʽ��4Mn++nO2+2nH2O+4ne�C=4M��OH��n
���𰸡�D
��������
���������A����Ӧ��Ӵ����Խ��Ӧ����Խ�죬���Բ��ö�缫��Ŀ������ߵ缫��������Һ�ĽӴ��������������������ɢ���缫���棬�Ӷ���߷�Ӧ���ʣ���A��ȷ��B����ص������۱�������ָ��λ�����ĵ缫�������������ͷų��������ܣ���λ�����ĵ缫����ʧȥ���ӵ����ʵ���Խ����õ��ĵ���Խ�࣬������������1gʱ�������ֽ���ת�Ƶ������ʵ����ֱ�Ϊ![]() ��2=
��2=![]() mol��
mol��![]() ��3=
��3=![]() mol��
mol��![]() ��2=
��2=![]() mol������Al-������ص����۱�������ߣ���B��ȷ��C��������Mgʧ��������Mg2+��Ϊ��ֹ����������Mg��OH��2������������Һ���ܺ��д���OH-�������˲������Ե���ʼ������ӽ���Ĥ����C��ȷ��D�������������õ��Ӻ�ˮ��Ӧ����OH-����Ϊ�������ӽ���Ĥ�����������Ӳ��ܽ�������������������ӦʽΪO2+2H2O+4e-=4OH-����D����ѡD��
mol������Al-������ص����۱�������ߣ���B��ȷ��C��������Mgʧ��������Mg2+��Ϊ��ֹ����������Mg��OH��2������������Һ���ܺ��д���OH-�������˲������Ե���ʼ������ӽ���Ĥ����C��ȷ��D�������������õ��Ӻ�ˮ��Ӧ����OH-����Ϊ�������ӽ���Ĥ�����������Ӳ��ܽ�������������������ӦʽΪO2+2H2O+4e-=4OH-����D����ѡD��


 ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������й�ʵ�����������˵������ȷ���� ������ĸ����
A���ζ�ʱ���۾�Ӧʼ��ע�ӵζ�����Һ��ı仯
B���ζ�ʵ�鶼��Ҫָʾ��
C������к͵ζ�֮ǰ����ƿ������ˮϴ�����ɣ������ô���Һ��ϴ
D����pH��ֽ����ij��Һ��pHʱҪ�Ƚ���ֽ��ʪ
E���ζ��ܾ�����ˮϴ����ֱ��ע���Һ����ʹ��õĴ���ҺŨ��ƫ��
F���ù㷺pH��ֽ����H2SO4��Һ��pHʱ�����pH=3.2
G���ⶨ���ζ����ߣ���ʼʱ���Ժͼ�¼�ļ������СЩ���ζ����յ㸽����Ҫ��Щ
��2��NaHSO3��Һ�� �ԣ�ԭ�� ���û�ѧ����ͱ�Ҫ������˵����������Һ������Ũ���ɴ�С���� ��
��3��t��ʱ��ˮ�����ӻ�KW��1��10-13��pH��11��NaOH��Һa L��pH��1��ϡ����b L��������Һ����仯���Բ����� �����û��Һ��pH��2����a��b�� ��
��4����֪PbI2��Ksp��7.0��10��9����7.5��10��3mol/L��KI��һ��Ũ�ȵ�Pb��NO3��2��Һ��2��1�������ϣ�������PbI2��������Pb��NO3��2��Һ����СŨ��Ϊ �����������
A��8.4��10��4 B��5.6��10��4 C��4.2��10��4 D��2.8��10��4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��������˵����ȷ����(����)
A. �����������ʶ�����ζ������һ��������ˮ
B. �����Ǻ������ʲ�ͬ��������ʽ��ͬ
C. �����������ά����ø����������ˮ��Ϊ������
D. �����Ǻ����Dz���ͬ���칹�壬������ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��H2��CO��CH4 ��C3H8 ��ȼ���ȷֱ���285.8 kJ/mol��283.0 kJ/mol��890.3 kJ/mol ��2220.0 kJ/mol ������������⼸������ȼ�գ���������������
A��C3H8 B��CO C��H2 D��CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮƿ���������õĻ�ԭ����(����)
A. �������� B. ������Һ C. ������ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����50mL0.50mol/L������50mL0.55mol/LNaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ����к��ȡ��ش��������⣺
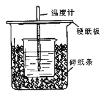
(1)��ϸ�۲�ʵ��װ�ã�ͼ���Ƿ�ȱ��һ�ֲ�����Ʒ�����ȱ�٣�ȱ�ٵ��� (���������ƣ������ȱ�٣��˿ղ��)��ͼ���Ƿ��в���֮�����������ָ�� (���û�У��˿ղ��)
(2)�ձ���������ֽ���������� ��
(3)���ձ����粻��Ӳֽ�壬��õ��к�����ֵ (����ƫ��ƫС����Ӱ����)
(4)����ͬŨ�Ⱥ�����Ĵ������������Һ��������ʵ�飬��õ��к�����H�� ��(����ƫ��������ƫС��������Ӱ����)��
(5)�����60mL0.50mol/L������50mL0.55mol/LNaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������� (������ȡ��������)�������к��� (������ȡ��������)����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ϩ ������ϩ ���� ���ױ� ����ȩ �����л��������У�����������ԭ�Ӿ���ͬһƽ����ǣ� ��
A.�٢ڢ� B.�ڢۢ� C.�ڢۢ� D.�٢ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ȡ50.0mLNa2CO3��Na2SO4�Ļ����Һ���������BaCl2��Һ��õ�14.51g��ɫ�������ù���ϡ���ᴦ������������ٵ�4.66g����������ų����Լ��㣺
��1��ԭ���Һ��CO32-�����ʵ���Ũ��Ϊ��Na+�����ʵ���Ũ��Ϊ��
��2�������������ڱ�״���µ����L��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����¯������ұ��������Ҫ��������������Ҫ��ӦΪ��
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)��H=akJ��mol-1
2Fe(s)+3CO2(g)��H=akJ��mol-1
(1)��֪����Fe2O3(s)+3C(ʯī)=2Fe(s)+3CO(g) ��H1=+489.0kJ��mol-1
��C(ʯī)+CO2(g)=2CO(g) ��H2=+172.5kJ��mol-1����a = kJ mol-1��
(2)ұ������Ӧ��ƽ�ⳣ������ʽK = ���¶����ߺ���Kֵ (��������������������������С��)��
(3)��T��ʱ���÷�Ӧ��ƽ�ⳣ��K=64����2 L�����ܱ����������У��ֱ��±���ʾ�������ʣ���Ӧ����һ��ʱ���ﵽƽ�⡣
Fe2O3 | CO | Fe | CO2 | |
��/mol | 1.0 | 1.0 | 1.0 | 1.0 |
��/mol | 1.0 | 2.0 | 1.0 | 1.0 |
����������CO��ƽ��ת����Ϊ ��
������˵����ȷ���� (����ĸ)��
a���������������ܶȺ㶨ʱ����־��Ӧ�ﵽƽ��״̬
b����������CO��ƽ��ת���ʴ����ҵ�
c���ס��������У�CO��ƽ��Ũ��֮��Ϊ2��3
d������Fe2O3�������CO��ת����
(4)��ȡһ����ʩ�ɷ�ֹ������ʴ������װ���е��ձ����ʢ�е�Ũ�ȡ��������NaCl��Һ��
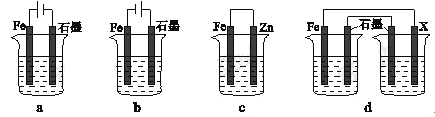
����a~cװ���У��ܱ��������� (����ĸ)��
������dװ�ñ�������X���ĵ缫����Ӧ�� (������)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com