
| A. | 铜与稀硝酸反应制取NO2 | |
| B. | 碳酸钙与稀盐酸反应制取二氧化碳 | |
| C. | 双氧水在MnO2催化下反应制取氧气 | |
| D. | 氯化铵固体与氢氧化钙固体混合加热制取氨气 |
分析 A.铜和稀硝酸反应生成硝酸铜、一氧化氮和水,不能制备NO2,铜和浓硝酸反应生成硝酸铜,二氧化氮和水;
B.实验室通常用稀盐酸与大理石(或石灰石)反应制取二氧化碳;
C.MnO2催化双氧水分解制O2 ;
D.实验室用固体氯化铵和固体氢氧化钙反应制备氨气.
解答 解:A.硝酸具有强氧化性,铜和稀硝酸反应生成硝酸铜、一氧化氮和水,化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,制备NO2需用浓硝酸,铜与浓硝酸发生氧化还原反应,生成硝酸铜,二氧化氮和水,反应的化学方程式为Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O,故A错误;
B.碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,反应方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,可制取二氧化碳,故B正确;
C.过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_{2}\;}}{\;}$2H2O+O2↑,可制取氧气,故C正确;
D.实验室用固体氯化铵和固体氢氧化钙反应制取氨气,反应的方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O,故D正确;
故选A.
点评 本题考查气体的制备,属于基本实验操作的考查,侧重于实验方案的评价,注意把握物质的性质以及常见气体的制备要点,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钾离子结构示意图: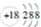 | |
| B. | N2H4的电子式: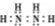 | |
| C. | 聚丙烯的结构简式: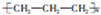 | |
| D. | 中子数为79、质子数为55的铯(Cs)原子:${\;}_{55}^{79}$Cs |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属性:Na<Mg | |
| B. | 原子半径:Na>Mg | |
| C. | 单质的还原性:Na<Mg | |
| D. | 最高价氧化物对应水化物的碱性:NaOH<Mg(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | ④ | ⑤ | |||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
| 4 | ⑩ |
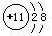 .元素⑩名称为溴.
.元素⑩名称为溴.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化碳有氧化性,在点燃条件下能将金属镁氧化 | |
| B. | 二氧化硫有漂白、杀菌性能,可在食品加工中大量使用 | |
| C. | 二氧化氯具有还原性,可用于自来水的杀菌消毒 | |
| D. | 二氧化锰具有较强的氧化性,可作H2O2分解的氧化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
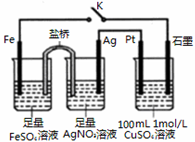
| A. | 盐桥中的电解质可以用KC1 | |
| B. | 闭合K,石墨电极上只生成铜 | |
| C. | 当有0.1mol Fe溶解时,流经电解液的电子个数为1.204×1023 | |
| D. | 导线中流过0.3mol电子时,加入11.1gCu2(OH)2CO3,CuSO4溶液可恢复原组成 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
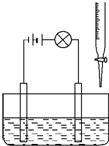 在烧杯里加入20mL 0.1mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):
在烧杯里加入20mL 0.1mol/L的Ba(OH)2溶液,再滴几滴酚酞试液,然后用滴定管向烧杯中滴加等物质的量浓度的NaHSO4溶液.实验装置如图(夹持仪器已去掉):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.5mol.L-1硫酸钠溶液中含有溶质离子总数为1.5NA | |
| B. | 标准状况下,22.4L甲醇完全燃烧产生NA个CO2分子 | |
| C. | 常温常压下,46g NO2、N2O4混合物中,分子数为NA | |
| D. | 常温常压下,N2和O2混合气体22.4L所含的分子数少于6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com