
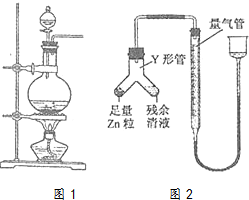
 实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示)
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如图1所示)分析 (1)依据反应物及制取气体的操作步骤分析解答,检查装置气密性后,加药顺序一般是先加入固体药品,再加入液药品,最后再加热;
(2)甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应;
(3)依据滴定实验过程中的化学反应定量计算;
(4)部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大;
(5)依据锌粒与稀盐酸反应生成氢气进行分析解答;化学反应释放热量,气体体积具有热胀冷缩的特点.使Zn粒进入残余清液中让其发生反应.这样残余清液就可以充分反应,如果反过来,残余清液不可能全部转移到左边.若残余清液转移到左边则会残留在Y型管内壁,导致产生气体的量减少,使测定的盐酸浓度偏小;反应完毕时,相同时间内则气体体积减少,又排除了其它影响因素,只能从气体本身角度思考,联想到该反应是放热的,就可能想到气体未冷却了.
解答 解:(1)加药顺序一般是先加入固体药品,再加入液药品,最后再加热,检查装置气密性后,先加入固体,再加入液体浓盐酸,然后加热,则依次顺序是ACB,
故答案为:ACB;
(2)二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,所以甲方案错误,故答案为:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应;
(3)a、量取试样20.00mL,用0.1000mol•L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为,由CHClVHCl=CNaOHVNaOH可得出盐酸的浓度为0.1100mol/L;故答案为:0.1100;
b、采用此方案还需查阅资料知道的数据是Mn2+开始沉淀时的pH;
故答案为:Mn2+开始沉淀时的pH;
(4)碳酸钙转化为碳酸锰说明实现了沉淀转化,碳酸钙存在沉淀溶解平衡;由于部分碳酸钙与转化成碳酸锰沉淀,称量剩余的固体质量会偏大,这样一来反应的固体减少,实验结果偏小,
故答案为:沉淀溶解平衡;偏小;
(5)①丁同学的方案中使Y形管中的残余清液与锌粒反应,故答案为:锌粒;残留溶液;
②气体体积逐渐减小,气体体积逐渐减小的原因是气体未冷却到室温,当温度冷却到室温后,气体体积不再改变;
故答案为:气体未冷却到室温.
点评 本题考查了实验室制备氯气的试剂添加顺序,中和滴定的 实验操作和计算应用,题目综合性较强,掌握实验室制取氯气的实验步骤是解答的关键,难度中等.


科目:高中化学 来源: 题型:实验题
 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定有甲烷和乙烯 | ||
| C. | 混合气体中一定有乙炔 | D. | 混合气体中一定没有乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | VA=3.0mol•L-1•min-1 | B. | VB=0.2mol•L-1•s-1 | ||
| C. | VC=4.8mol•L-1•min-1 | D. | VD=4.0mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
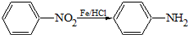 (苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.
(苯胺,易被氧化).甲苯是一种重要的有机化工原料,可用来合成多种重要的有机物.以甲苯为初始原料合成阿司匹林等有机物的转化关系图(部分产物、合成路线、反应条件略去)如下.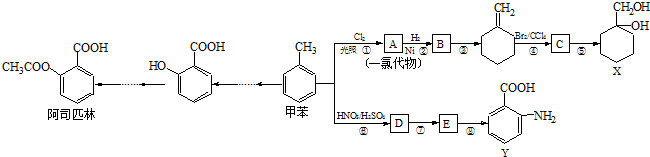
 ,C
,C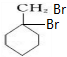 ,E
,E .
.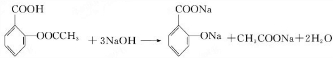 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,该氢化物可以与H+离子以配位键相合,产物的结构式
,该氢化物可以与H+离子以配位键相合,产物的结构式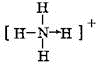 .
. ,1mol O22+中含有的π键为2mol.
,1mol O22+中含有的π键为2mol.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | D>B>A>C | C. | D>A>C>B | D. | C>A>B>D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com