
| A、常温下pH相同的下列溶液:①NaHCO3 ②Na2CO3 ③CH3COONa,其溶液的浓度由大到小的顺序是:③>①>② |
| B、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)═c(OH-)+c(HA-)+c(A2-) |
| C、pH=10的NaOH溶液与pH=4的CH3COOH溶液等体积混合:C(Na+)>C(CH3COO-)>C(OH-)>C(H+) |
| D、0.1mol/L的氨水溶液与0.05mol/LH2SO4溶液等体积混合后所得溶液中:C(NH4+)+C(NH3?H2O)+C(NH3)═C(SO42-) |


科目:高中化学 来源: 题型:
| A、浓氨水 |
| B、NaOH溶液 |
| C、CCl4 |
| D、AgNO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向某无色溶液中先加入氯化钡溶液,生成白色沉淀,在加入足量盐酸,沉淀不溶解,说明原溶液中含有SO42- |
| B、用分液的方法分离溴和CCl4的混合物 |
| C、用水鉴别苯,四氯化碳,酒精三种液体 |
| D、用向上排空气法收集NO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、除去石英中混有的少量铝粉,可加入氢氧化钠溶液溶解后过滤 |
| B、向含有少量FeBr2的FeCl2溶液中,加入适量氯水,再加CCl4萃取分液,以除去FeCl2溶液中的FeBr2 |
| C、除去乙酸乙酯中混有的少量乙酸,加入饱和氢氧化钠溶液振荡后分液 |
| D、已知:Ksp(CuS)<Ksp(FeS),可加入过量的难溶电解质FeS,使水中少量的Cu2+转化成硫化物沉淀而除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、SO42-、HCO3- |
| B、CO32-、K+、Ca2+ |
| C、Fe3+、Cl-、OH- |
| D、Ag+、K+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
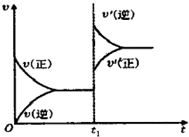 往一体积不变的密闭容器中充入H2(g)+I2(g)?2HI(g);△H<0,当达到平衡后,t1时,若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )
往一体积不变的密闭容器中充入H2(g)+I2(g)?2HI(g);△H<0,当达到平衡后,t1时,若保持混合气体总物质的量不变而改变某一反应条件,使容器内压强增大(如图所示),下列说法正确的是( )| A、t1时,减小体积或升高体系温度 |
| B、平衡不移动,混合气体的密度增大 |
| C、H2的转化率增大,HI的平衡浓度减小 |
| D、容器内气体颜色变深,平均相对分子质量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com