
离子方程式H++OH-=H2O可表示的化学方程式是
A.盐酸与氢氧化铜的反应 B.硫酸与氢氧化钡的反应
C.硫酸与氢氧化钠的反应 D.盐酸与氨水的反应
科目:高中化学 来源: 题型:
用Na2CO3·10H2O固体,配制0.2 mol·L-1的Na2CO3溶液480 mL。
(1)本实验用到的仪器除托盘天平、烧杯、玻璃棒、胶头滴管外还需要 ,应称取Na2CO3·10H2O固体的质量:________。
(2)下列操作中,容量瓶所不具备的功能有 。
A.配制一定体积准确浓度的标准溶液 B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.准确稀释某一浓度的溶液
E.用来加热溶解固体溶质
(3)配制0.2 mol·L-1的Na2CO3溶液480 mL的主要步骤有:①溶解②计算③转移洗涤 ④定容摇匀 ⑤称量;正确的操作顺序是: 。(填序号)
(4)根据下列操作对所配溶液的浓度产生的影响,完成下列要求:
①Na2CO3·10H2O固体失去了部分结晶水
②用“左码右物”的称量方法称量固体(使用游码)
③碳酸钠固体不纯,其中混有氯化钠
④称量碳酸钠固体时所用砝码生锈
⑤容量瓶未经干燥使用
⑥定容摇匀后,发现液面低于刻度线,再加水至刻度。
⑦定容时仰视刻度线。
其中引起所配溶液浓度偏高的有________(填序号,下同),偏低的有 。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列说法正确的是________(选填序号)。
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.配制银氨溶液时,应把硝酸银溶液逐滴加入氨水中
C.一般在实验室点燃可燃性气体时,必须先要检验纯度
D.测定硫酸铜晶体结晶水的质量分数时,若用潮湿的坩埚会使测定结果偏小
E.酸碱中和滴定实验中根据碱式滴定管的两次读数得出NaOH溶液体积为22.0 mL
F.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
a.配制0.01 mol/L到0.008 mol/L等一系列浓度的[Fe(SCN)6]3-(红色)溶液作为标准比色液。
b.样品处理:
c.准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10 mL。
d.比色:选取与待测液颜色一致或相近的标准比色液即可判断待测液的浓度。
试回答下列问题:
①配制100 mL 0.01mol/L标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:________、________。
②步骤b脱色过程包括加入:________(填:脱有机色素的吸附剂名称)→搅拌→煮沸→冷却→________(填操作)。
③步骤b样品处理中,氧化的目的是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应属于氧化还原反应的是
A.CaCO3+2HCl=CaCl2+CO2↑ + H2O B.2H2O2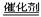 2H2O+O2↑
2H2O+O2↑
C.CaO+H2O=Ca(OH)2 D.CaCO3 CaO+CO2↑
CaO+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
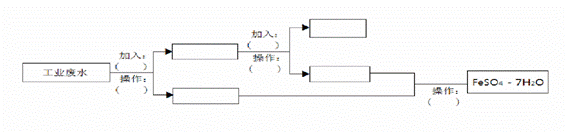
某工厂的工业废水中含有大量的FeSO4、较多的Cu2+和少量的Na+。为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜。请根据流程图,在方框和括号内填写物质名称(或主要成分的化学式)或操作方法,完成回收硫酸亚铁和铜的简单实方案
查看答案和解析>>
科目:高中化学 来源: 题型:
已知下述三个实验中的物质均能发生化学反应。
| ① | ② | ③ |
| 将铁钉放入硫酸铜溶液中 | 向硫酸亚铁溶液中滴入几滴浓硝酸 | 将铁钉放入氯化铁溶液中 |
下列判断正确的是( )
A.实验①和③中的铁钉只作还原剂
B.上述实验证明氧化性:Fe3+>Fe2+>Cu2+
C.实验②中Fe2+既显氧化性又显还原性
D.实验③中反应的离子方程式为Fe+Fe3+===2Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学欲探究食品添加剂铵明矾NH4Al(SO4)2·12H2O高温分解的情况。
(1)预测产物:下列关于气体产物的预测不合理的是 。
A.NH3、N2、SO2、H2O B.NH3、SO3、H2O
C.NH3、SO2、H2O D.NH3、N2、SO3、SO2、H2O
(2)定性检验:取一定量铵明矾,设计下列实验探究产物 。
①按图示组装仪器后,首先检查整套装置的气密性,操作是________。
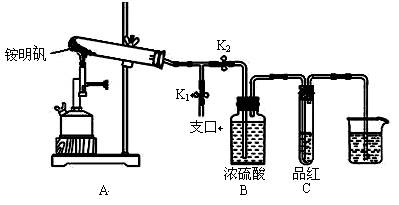
②夹住止水夹K1,打开止水夹K2,用酒精喷灯充分灼烧。实验过程中,装置A和导管中未见红棕色气体;试管C中的品红溶液褪色;在支口处可检验到NH3,方法是;在装置A与B之间的T型导管中出现白色固体,该白色固体可能是_________(任填一种物质的化学式)。
③分析得出装置A试管中残留的白色固体是两性氧化物,写出它溶于NaOH溶液的离子方程式。
④为了防止倒吸,实验结束时必须先____________(填字母序号),然后熄灭酒精喷灯。
A.取出烧杯中的导管 B.打开止水夹K1 C.关闭止水夹K2
(3)分析和结论:实验证明气体产物是(1)D中的5种气体。相同条件下测得生成N2和SO2的体积比是定值,V(N2):V(SO2)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在实验室中,用镊子从煤油中取出一小块金属钠,然后用滤纸将煤油吸干,再用小刀 切开观察。在这一实验过程中不能得出的钠的物理性质是
A.钠在常温下是固体 B.钠具有银白色的金属光泽
C.钠的熔点很低 D.金属钠很软
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com