
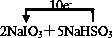 ,故答案为:
,故答案为: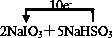 .
.


科目:高中化学 来源: 题型:
| A、探究SO2和Na2O2反应可能有Na2SO4生成 |
| B、探究NO和N2O可能化合生成NO2 |
| C、探究NO2可能被NaOH溶液完全吸收生成NaNO2、NaNO3和H2O |
| D、探究向滴有酚酞试液的NaOH溶液中通入Cl2,酚酞红色褪去的原因是溶液的酸碱性改变还是HClO的漂白作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2为0.4 mol?L-1,O2为0.2 mol?L-1 |
| B、SO2为0.25 mol?L-1 |
| C、SO2和SO3均为0.15 mol?L-1 |
| D、SO2为0.4 mol?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲>乙 | B、甲<乙 |
| C、甲=乙 | D、无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cl- SO42- |
| B、Cl- NO3- |
| C、Cl- CO32- |
| D、Cl- OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO2、H2S、Cl2 |
| B、O2、CO2、NO |
| C、O2、H2、SO2 |
| D、NH3、N2、HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、平衡向正反应方向移动 |
| B、a<c+d |
| C、D的体积分数变大 |
| D、A的转化率变大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com