
分析 混合物由两种或两种以上不同物质组成的物质;
酸是指在电离时产生的阳离子全部是氢离子的化合物;
电解质是在熔融状态或水溶液中能导电的化合物;
盐是指在电离时生成金属离子或铵根离子(NH4+)与酸根离子或非金属离子的化合物.
解答 解:④H2SO4电离时产生的阳离子全部是氢离子,属于酸;
③氢氧化钠溶液 ⑥Fe(OH)3胶体是由多种物质组成的,属于混合物;
④H2SO4 ⑦NaHCO3在熔融状态下或水溶液中能导电,属于电解质;
⑦NaHCO3电离时产生钠离子和碳酸氢根离子,属于盐;
故答案为:④;③⑥;④⑦;⑦.
点评 本题考查混合物、电解质、酸等概念,题目难度不大,但涉及物质较多,注意不要漏选.


 全优点练单元计划系列答案
全优点练单元计划系列答案科目:高中化学 来源: 题型:解答题

| 共价键 | H-H | Cl-Cl | H-Cl |
| 键能/(kJ•mol-1) | 436 | 247 | 434 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4 L CCl4中所含分子数为NA | |
| B. | 标准状况下,18g水所含原子数为NA | |
| C. | 常温常压下,11.2 LCO2所含的原子数为1.5NA | |
| D. | 常温常压下,48 g O2与O3混合物含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
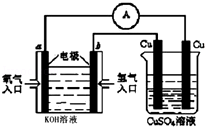 氨气是一种重要工业原料,在工农业生产中具有重要的应用.
氨气是一种重要工业原料,在工农业生产中具有重要的应用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com